
Способы получения сн4
в промышленности
а) из природного газа
б) из СО и Н2 – синтез Фишера-Тропша : СО + 3Н2 Ni, 300˚, P CH4 + Н2О
(t = 175˚-215˚)
2) в лаборатории:
а) Al4C3 + 12HCl → 4AlCl3 + 3CH4↑
Al4C3 + 12 HOH → 4Al(OH)3 + 3CH4↑
б) при сплавлении солей уксусной кислоты со щелочами:
CH3[COONaтв. + NaO]H t˚ CH4↑ + Na2CO3
Получение гомологов метана.
1) в промышленности
а) из природного сырья – нефть, природный газ, горный воск
б) nCO + (2n+1)H2 300˚, Fe CnH2n+2 + nH2O
2) в лаборатории:
а) каталитическое гидрирование алкенов, алкинов, циклоалканов.
Н2С = СН2 + Н2 Pt, (Ni - 150˚) H3C – CH3
HC ≡ CH + 2Н2 Pt H3C – CH3

+ Н2 Ni, t˚ C3H8
б) реакция Вюрца (1855 г.) взаимодействие галогеноалканов с металлическим натрием
CH3 – [Br + Na] + [Na + Br] – CH3 t˚ CH3 – CH3 + 2 NaBr
3CH3 – I + 6Na + 3I – CH – CH3
CH3
CH3 – CH – CH3 + CH3 – CH3 + CH3 – CH– CH – CH3 + 6NaI
CH3 CH3 CH3
в) гидролиз магнийорганических соединений
R – CH2Br + Mg R – CH2MgBr + HOH R – CH3 + Mg(OH)Br
г) восстановление галогеноалканов водородом (Pd) или йодоводородом
C3H7Cl + H2 Pd, t˚ C3H8 + HCl
C3H7I + HI t˚ C3H8 + I2 (R – I > R – Br > R – I акт. уменьшается)
д) сплавление солей карбоновых кислот со щелочами.
C2H5COONa + NaOH спл. С2Н6 + Na2CO3
Применение сн4
в составе природного газа используется как топливо в быту и на производстве.
CH3Cl, CH2Cl, CHCl3, CCl4 – растворители
CF2Cl2 – фреон
СН4 > 1000˚ С + 2Н2↑ С – сажа, в производстве типографической краски
Для получения ацетилена, этаналя, уксусной кислоты:
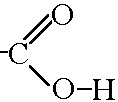
2СН4 1500˚ С2Н2+ 3Н2↑ С2Н2+ Н2О Hg2+ CH3 [O] CH3
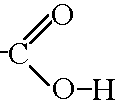
[CH3 – OH + CO [Rh(CO)2I2] CH3 ]
Для получения синтез газа: СН4 + Н2О Ni, 30атм., 750˚ - 850˚ СО↑ + 3Н2↑
[CO + 2Н2 Cu, ZnO, 250˚, P CH3OH
Для получения метанола: СН4 + Сl2, hν, -HCl CH3Cl + NaOH, H2O CH3OH + NaCl
Для получения формальдегида, фенолформальдегидной пластамассы
СН4 + О2t˚, kat H + H2O

OH OH OH OH


 H
H O H H CH2
CH2
CH2
H
H O H H CH2
CH2
CH2

 ║ ║
║ ║
+ CH2 + + O t˚, -nH2O …
