
- •Обоснование выбор мономера для получения предложенной полимерной системы
- •Образование названия полимерных систем. Номенклатура полимеров
- •Составным повторяющемся звеном данной полимерной системы является метилен группа —сн2_—, поэтому по систематической номенклатуре полимер будет иметь название – полиметилен.
- •2) По рациональной номенклатуре для обозначения синтетических полимеров ставят перед названием мономера приставку поли-, если название мономера включает несколько слов, то оно берется в скобки.
- •Обоснование выбора мономера
- •Определение функциональности мономера исходя из строения мономера и их способности к образованию полимеров
- •Электронное и геометрическое строение этилен, определяющего его функциональность в реакции полимеризации
- •Полимераналогичные реакции
- •Реакции усложнения полимеров
- •Реакции деструкции полимеров
- •Термическая деструкция
- •Термоокислительная деструкция
- •Горение
- •Пути повышения огнестойкости полимерных материалов
Электронное и геометрическое строение этилен, определяющего его функциональность в реакции полимеризации
Атомы углерода в этилене находятся в sp2-гибридизованном состоянии. Каждый атом углерода образует по три -связи с использованием sp2-гибридизованных орбиталей. Угол между -связями близок к 1200. Молекула этилен плоская. Длина связи С=С равна 0.133 нм.
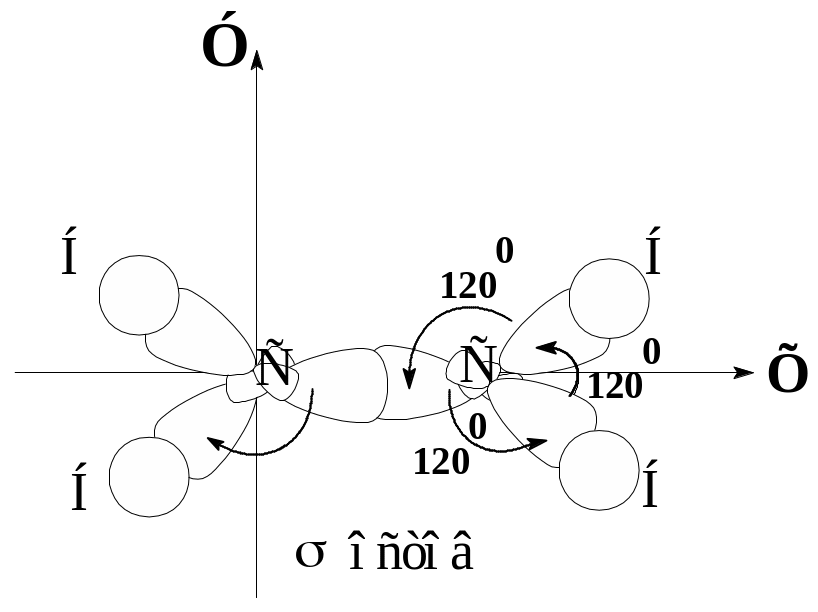
Рисунок. Схематическое изображение образования σ- остова в молекуле этилена
Оставшиеся две pz – орбитали перекрываются между собой. “Боковое” перекрывание pz – атомных орбиталей образует - связь. - Связи располагаются в плоскости ху, а - связь – в плоскости xz.
![]()
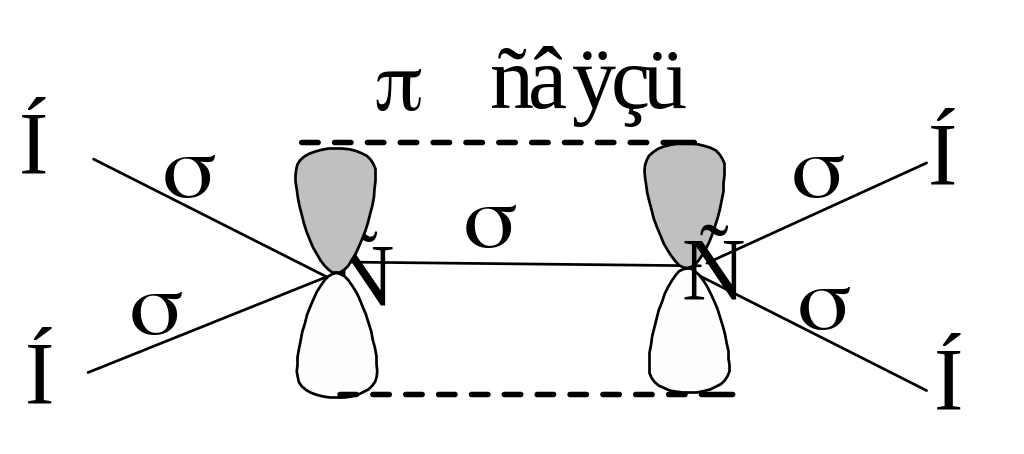
Рисунок. Схематическое изображение образования кратной двойной связи в молекуле этилена.
Величина энергии С=С связи равна 610 кДж/моль. Поскольку энергия связи С-С равна 350 кДж/моль, энергия - связи равна 260 кДж/моль.
Энергия - связи объясняет способность алкенов к реакциям присоединения, протекающим с разрывом - связи. Электроны - связи находятся дальше атомных ядер, поэтому они более подвижны, чем электроны - связи, и более уязвимы для атаки реагентов. - Электроны играют роль экранирующей оболочки молекулы от атаки нуклеофильными реагентами. В связи с эти алкены взаимодействуют с электрофильными реагентами.
Например:
Реакции электрофильного присоединения.
Присоединение хлора и брома.
Иод не присоединяется по двойной связи, а в атмосфере фтора углеводороды сгорают.
Присоединение хлора и брома проходит в полярных растворителях (вода, спирты, уксусная кислота).
Пример:

Механизм реакции:
1 –стадия: быстрое и равновесное образование - комплекса или комплекса с переносом заряда.

Под действием богатой электронами - связи связь между атомами хлора разрыхляется, и молекула хлора поляризуется. Поляризованная молекула
хлора взаимодейсвует с - связью.
2 – стадия: разрыв - связи в молекуле хлора и разрыв - связи алкена. Галоген вытягивает - электронную пару для образования связи C-Cl, при этом образуется карбокатион.

3 – стадия: быстрое взаимодействие карбокатиона с хлорид-анионом.

Присоединение галогеноводородов (в растворе и в газовой фазе).
Рассмотрим на примере пропилен:

Присоединение галогеноводородов к несимметричным алкенам проходит по правилу Марковникова: протон присоединяется к более гидрогенизированному атому углерода. Эту направленность реакции можно объяснить с помощью классической электронной теории. Молекула несимметрично замещенного алкена поляризована, и алкильные группы как электронодонорные заместители определяют наиболее вероятное место присоединения протона.
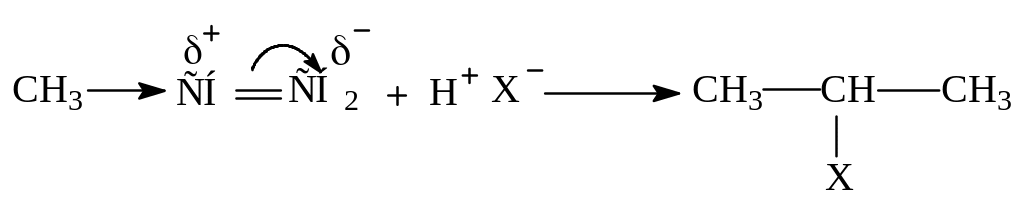
Механизм реакции:
1 стадия: быстрое и равновесное образование - комплекса.

2 стадия: медленное образование карбокатиона.
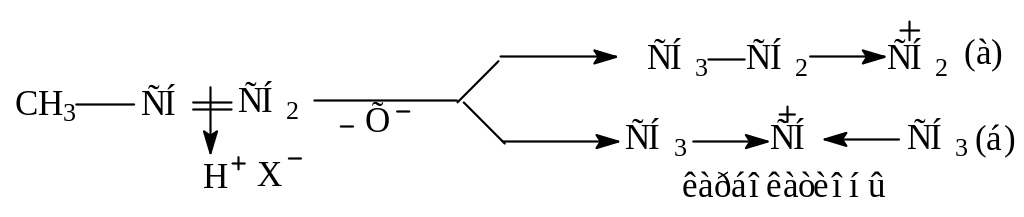
Реакция проходит через образование наиболее стабильного вторичного карбокатиона (б). Его стабилизация достигается за счет (+I) – эффекта двух соседних электронодонорных метильных групп, тогда как в случае карбокатиона (а) сдвиг - электронной плотности происходит только от одной этильной группы.
3 стадия: быстрое взаимодействие карбокатиона (б) с анионом Х-.
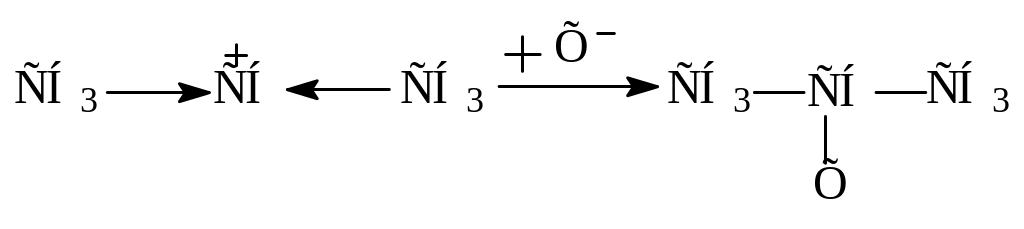
По устойчивости карбокатионы располагаются в ряд:
трет. R+ втор. R+ перв. R+ СН3
Присоединение воды (реакция гидратации).
Присоединение воды происходит только в присутствии катализаторов (H2SO4, H3PO4 на силикагеле).
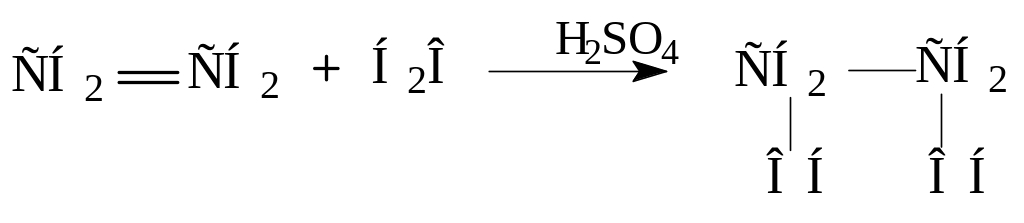
Роль H2SO4:
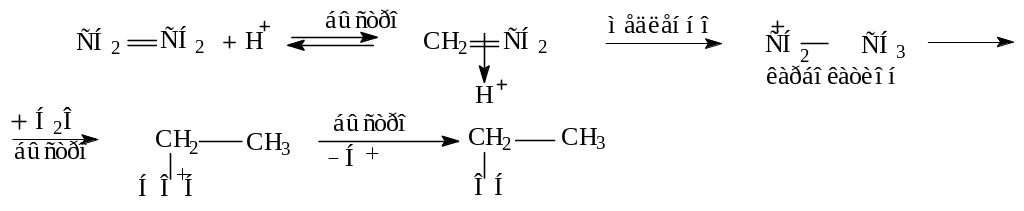
В промышленности реакцию проводят в газовой фазе.
Пример:
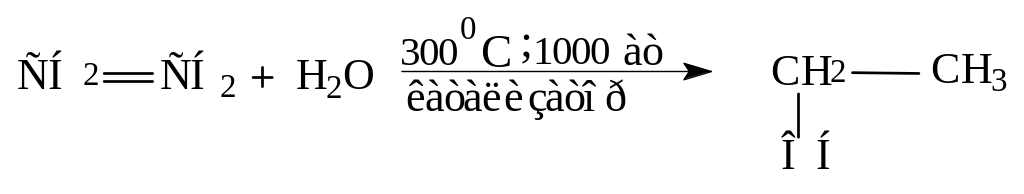
Окисление алкенов.
Окисление с помощью KMnO4 в водных растворах в слабощелочной среде при комнатной температуре.
Пример:

Окисление с помощью CrO3 в растворе уксусной кислоты или KMnO4 при нагревании.
Пример:
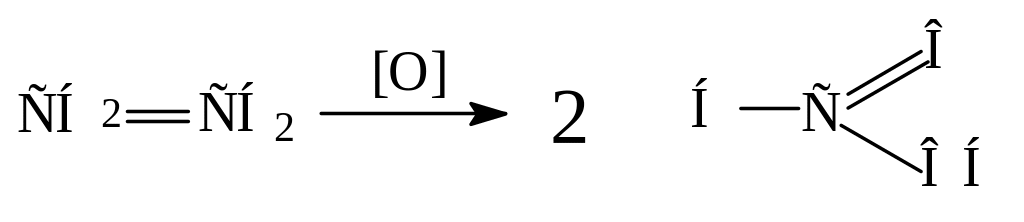
Окисление в присутствии солей палладия.
Пример:

Каталитическое окисление кислородом воздуха в присутствии Ag или надкислот.
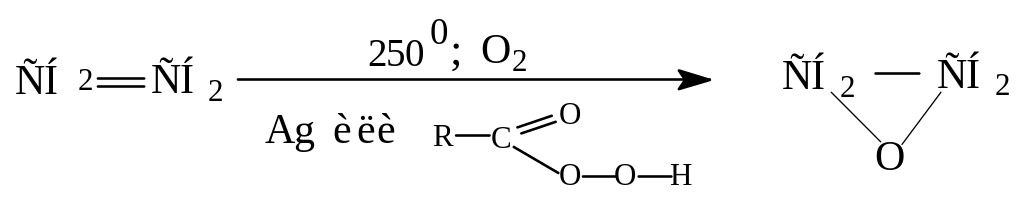
Реакция используется в лакокрасочной промышленности для получения эпоксидов.
Озонолиз.
Алкены легко реагируют с озоном и образуют взрывчатые соединения – озониды.
Пример:
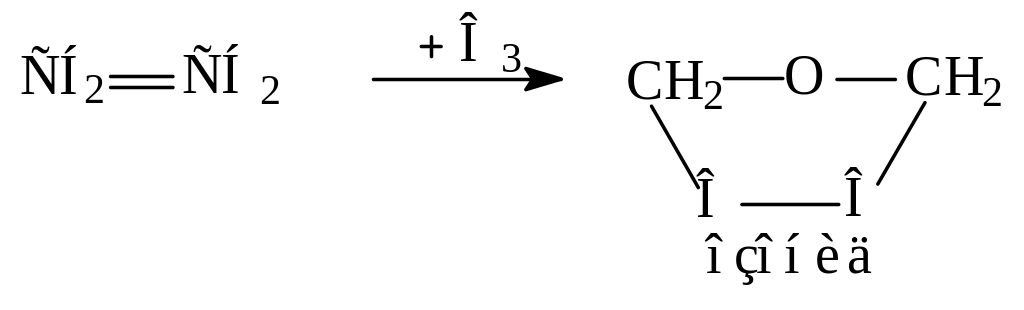
Гидрирование алкенов.
Гидрирование алкенов проходит с большим трудом в присутствии катализаторов (Pt, Pd, Ni) при 150-2500С.
Пример:

Реакции свободнорадикального присоединения.
Алкены способны присоединять бромистый водород в присутствии
пероксидов (перекисный эффект Караша). Рассмотрим данную реакцию
на пропилене
Пример:
![]()
Реакция идет в малополярных растворителях.
Механизм:

Реакция проходит через образование наиболее устойчивого радикала.
V. Реакции образования макромолекул полимеров.
Алкены способны вступать в реакцию полимеризации. Под термином «полимеризация» называют реакцию взаимодействия двух или более молекул ненасыщенных соединений или легко размыкаемых циклов, называемых мономерами, самопроизвольно или под действием инициатора приводящую к образованию димеров, тримеров и т.д. вплоть до высокополимеров. Макромолекула имеет тот же самый состав, что и исходное соединение. Полимеризация никогда не сопровождается отщеплением атомов или молекул. Часто связана с присоединением по концам полимера концевых групп (например, осколков инициатора). Реакции полимеризации бывают следующих типов.
Известна линейная цепная полимеризация, которая по механизму протекания реакции делится на:
- радикальную полимеризацию;
- ионную полимеризацию (катионную или анионную);
-координационную полимеризацию.
Изобразим механизм свободнорадикальной полимеризации заданного мономера (этилена). Данная реакция протекает через три стадии: зарождения цепи, рост цепи, обрыв цепи.
Реакция инициируется свободными радикалами, которые образуются при термическом распаде инициаторов типа пероксидов:
R-O-O-R 2RO•;
Зарождение цепи: СН2 = СН2 + RO• RO-CH2 –СН2•
Рост цепи:
RO-CH2–СН2• + СН2 = СН2 RO-CH2–СН2- СН2-СН2• и т.д.
RO-CH2 –СН2-[-CH2-СН2-]n-СН2-СН2•
Обрыв цепи:
а) 2RO-[-CH2-СН2-]n+1СН2-СН2•
RO-[-CH2-СН2-]n+1-СН2-СН2-CH2 –СН2-[-CH2-СН2-]n+1OR
б) RO-[-CH2-СН2-]n+1-СН2-СН2• + •OR RO-[-CH2-СН2-]n+1-СН2-СН2-OR
в) 2RO-[-CH2-СН2-]n+1-СН2-СН2• RO-[-CH2-СН2-]n+1-СН=СН2 +
+ RO-[-CH2-СН2-]n+1-СН2-СН3
Этим методом можно получит полиэтилен «высокого давления», так как температура полимеризации 2000С, а давление – 1000-1500 ат.
Определение химических свойств полимерных систем
химические превращения высокомолекулярных соединений бывают следующих типов:
Полимераналогичные реакции
Реакции усложнения полимеров
Реакции деструкции
Эти реакции проводят для того, чтобы установить строение полимера, синтезировать новые полимеры или модифицировать полезные свойства готовых полимеров. С другой стороны, под действием света, воды, воздуха и других факторов в полимерах могут происходить нежелательные процессы деструкции.
