
- •Моносахариды
- •Олигосахариды
- •Полисахариды
- •Биохимия липидов
- •1. Химический состав и биологическая роль липидов
- •2. Характеристика классов липидов
- •Нейтральные жиры
- •Структурная организация белков
- •Форма белковых молекул
- •Свойства белков
- •Нуклеиновые кислоты
- •Ферменты
- •Строение ферментов и коферментов
- •Свойства ферментов
Свойства ферментов
Для ферментов характерны высокая каталитическая активность, специфичность действия и регулируемость их активности.
Благодаря высокой каталитической активности ферментов скорость некоторых химических реакций увеличивается в миллионы раз. Примером может служить обратимая реакция синтеза и распада угольной кислоты, которую катализирует фермент карбоангидраза: СО2 + Н2О = Н2СО3. Одна молекула карбоангидразы эритроцитов способна связывать до 105 молекул СО2 в секунду, при этом скорость реакции в присутствии фермента увеличивается в 107 раз. Реакция синтеза Н2СО3 постоянно протекает в тканях организма при связывании метаболического СО2, а реакция распада Н2СО3 интенсивно протекает в капиллярах легких, где происходит выведение СО2 из организма при выдохе.
Очень высокую активность проявляет каталаза, которая катализирует расщепление токсичного для организма вещества — перекиси водорода: 2Н2О2 -> 2Н2О + О2. При температуре 0° С одна молекула каталазы разлагает 40 000 молекул Н2О2 в секунду.
Специфичность действия ферментов состоит в том, что фермент может катализировать превращение определенного субстрата или действовать на один из типов химических связей в нем. Благодаря этому в клетке множество химических реакций протекает одновременно в строго определенном порядке. Различают ферменты с абсолютной, относительной и групповой специфичностью. Абсолютная специфичность фермента проявляется в том, что он катализирует превращение молекул только одного субстрата. Например, фермент аргиназа способен катализировать распад только аргинина на мочевину и орнитин, а ферменты сахараза, мальтаза, лактаза способны расщеплять только соответствующие дисахариды. Относительной специфичностью действия обладают ферменты, которые катализируют разрыв определенного типа химической связи в молекулах разных веществ. Для них строение молекулы субстрата не имеет решающего значения. Относительная специфичность характерна для пептидаз пищеварительного тракта (пепсина, трипсина, химотрипсина), которые расщепляют пептидную связь в различных белках и пептидах, а также фосфатаз, липаз, которые расщепляют эфирные связи в молекулах различных веществ. Ферменты действуют только на один из нескольких изомеров субстрата. Групповая специфичность характерна для ферментов, которые действуют на субстраты с одинаковым типом связи и подобным строением молекул. Так, например, холинэстеразы расщепляют эфирную вязь во многих субстратах, которые содержат остаток холина.
Регуляция процессов синтеза ферментов осуществляется на уровне генов и на уровне транскрипции (синтеза иРНК). Такие изменения наблюдаются при долговременном воздействии различных факторов среды, физических нагрузок и стероидных гормонов.
Процессы адаптации организма к физическим нагрузкам взаимосвязаны с совершенствованием различных механизмов регуляции активности ферментов. При срочной адаптации к физическим нагрузкам изменяется активность уже существующих ферментов. При долговременной адаптации в организме усиливаются процессы синтеза белка, что приводит к увеличению количества ферментов. Такие изменения повышают адаптационные возможности обмена веществ. Благодаря регулируемости активности ферментов можно осуществлять коррекцию отдельных звеньев обмена веществ в организме, что является актуальной проблемой медицины и спорта.
Большинство химических составных частей живого организма способно к множеству различных превращений. Фермент, ускоряя только одну какую-либо реакцию, препятствует всем побочным реакциям и тем самым определяет направление основного биохимического процесса.
Скорость реакции зависит от строения молекул реагирующих веществ (реагентов), их концентрации, температуры, давления, наличия катализатора и некоторых других факторов.
Реакция становится возможной только при столкновениях молекул. Чем больше молекул в единице объема, тем чаще они сталкиваются, т.е. скорость реакции повышается.
Не каждое столкновение реагирующих молекул приводит к химической реакции. Чтобы реакция началась, молекулы должны обладать определенным запасом энергии, достаточным для преодоления энергетического барьера, который создается межмолекулярными силами отталкивания и внутримолекулярными силами сцепления (прочностью химических связей).
Особенно большое количество энергии нужно для разрыва ковалентных связей,
преобладающих в молекулах органических веществ. Когда энергетический барьер преодолен и реакция началась, в ходе ее может выделиться значительно больше энергии, чем затрачено на начало процесса. Изменения энергии, происходящие в ходе химических реакций, можно изобразить графически. Количество энергии, необходимое молю реагирующего вещества для вступления в реакцию, называется энергией активации и рассчитывается в кДж/моль.
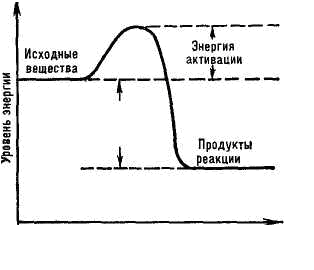
Чем больше в веществе активных (возбужденных) молекул, способных преодолеть энергетический барьер, тем выше скорость его химических превращений. Запас энергии зависит от особенностей химического строения молекул и тех внешних воздействий, которым они подвергаются. В обычных условиях только незначительная часть молекул вещества находится в активном состоянии. Активация их происходит при нагревании вещества, передаче ему лучистой энергии (например, в фотохимических реакциях), столкновениях с другими, уже возбужденными молекулами или атомами.
С повышением температуры на каждые 10° скорость реакции возрастает в среднем в 2—3 раза. Скорость реакции можно увеличить, повышая давление (если реагенты являются газами): активные молекулы сближаются, и частота столкновений между ними увеличивается.
В живых организмах большие колебания температуры и давления невозможны. В них создаются условия, в которых для взаимодействия веществ требуется меньшая энергия активации. Это достигается снижением энергетического барьера реакции за счет уменьшения сил отталкивания между молекулами и ослабления химических связей.
О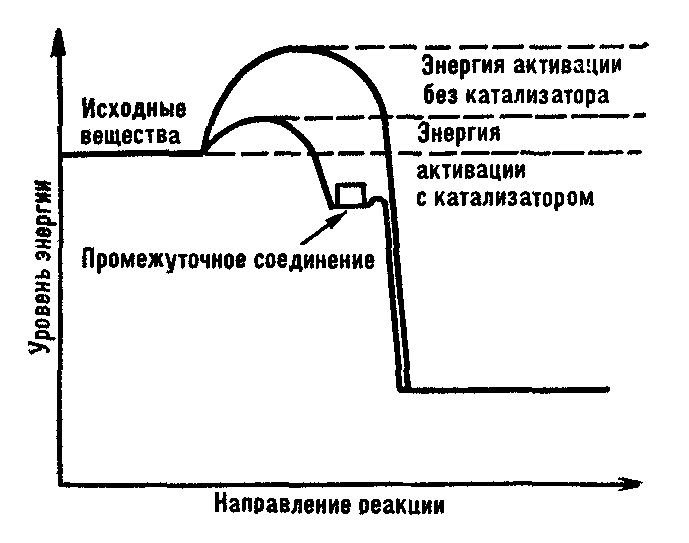 сновная
функция ферментов – снижение величины
энергетического барьера. Каталитическая
реакция идет по иному пути, чем
некаталитическая, — через стадию
образования промежуточного соединения
реагентов с катализатором. При
адсорбции реагирующих молекул на
поверхности катализатора силы взаимного
отталкивания между ними ослабевают.
Влияние электрического поля катализатора
приводит к деформации молекул
реагентов, смещению электронов в них и
сильному ослаблению связей, в
результате чего энергия активации
понижается. Изменение энергии при
каталитической реакции показано на
рис.
сновная
функция ферментов – снижение величины
энергетического барьера. Каталитическая
реакция идет по иному пути, чем
некаталитическая, — через стадию
образования промежуточного соединения
реагентов с катализатором. При
адсорбции реагирующих молекул на
поверхности катализатора силы взаимного
отталкивания между ними ослабевают.
Влияние электрического поля катализатора
приводит к деформации молекул
реагентов, смещению электронов в них и
сильному ослаблению связей, в
результате чего энергия активации
понижается. Изменение энергии при
каталитической реакции показано на
рис.
Согласно современным представлениям, механизм взаимодействия ферментов с субстратами связан с образованием нестойких ферментсубстратных комплексов
В процессе образования фермент-субстратного комплекса в субстрате происходит перераспределение энергии, что приводит к разрыву или образованию химических связей. Так, например, энергия активации сахарозы при гидролитическом расщеплении без фермента составляет 134 кДж / моль"1 (25,6 ккал / моль"1), а в присутствии фермента (сахаразы) — только 39,3 кДж/моль"1 (8 ккал/ моль-1).
Процесс взаимодействия фермента с субстратом протекает в несколько стадий, представленных на рис:
взаимодействие субстрата с активным центром фермента и образование ферментсубстратного комплекса;
преобразование первичного ферментсубстратного комплекса в другие ферментсубстратные комплексы, в ходе которых вещества переходят в активное состояние и далее распадаются на фермент и продукты реакции;
отделение продуктов реакции от активного центра фермента и диффузия их в окружающую среду.
Сам фермент в ходе реакции не изменяется и может взаимодействовать с новыми молекулами субстрата.
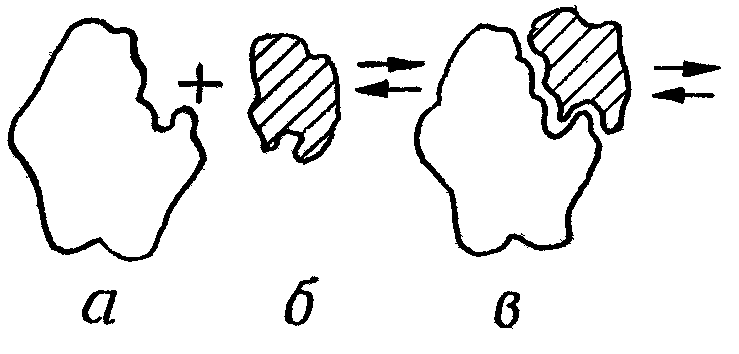
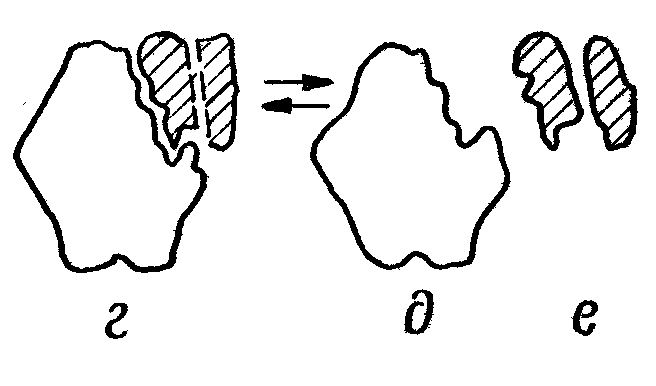
а- фермент б- субстрат в- фермент-субстрат- е- продукты реакции
ный комплекс
Факторы, влияющие на действие ферментов
Скорость биохимических реакций, которая определяется по изменению концентрации реагирующих или образовавшихся веществ в единицу времени, зависит от активности ферментов и условий протекания реакции. Каждый фермент имеет свои оптимальные условия проявления активности. Оптимальными считаются условия, при которых ферментативная реакция протекает с максимальной скоростью. На скорость ферментативных реакций влияют: количество фермента; концентрация субстрата; активная реакция среды (рН); температура; присутствие активаторов и ингибиторов.
Концентрация фермента и субстрата. Скорость ферментативной реакции увеличивается с увеличением количества фермента при высокой концентрации субстрата. В организме в состоянии относительного покоя многие ферменты не проявляют максимальную активность из-за низкой концентрации их субстратов. При мышечной деятельности усиливается энергетический обмен и накапливаются субстраты многих реакций, что способствует повышению активности многих ферментов.
Активная реакция среды. Каждый фермент имеет узкий диапазон значений рН, при котором активность его максимальна. Большинство ферментов проявляют максимальную активность в организме при значениях рН, близких к 7,0, т. е. в нейтральной среде (рис. 39). Однако отдельные .ферменты проявляют высокую активность в сильно кислой среде, например пепсин (рН 2,0), сахараза (рН 4,5), или щелочной среде, например трипсин (рН 8,0), липаза (рН 9,0), аргиназа (рН 9,7).
Влияние рН среды на активность ферментов связано с изменением степени ионизации их белковой молекулы под воздействием протонов Н или гидроксилов (ОН"), что в первую очередь влияет на структуру активного центра фермента.
В организме человека в состоянии относительного покоя диапазон колебаний рН незначителен и ферменты «работают» в своих оптимальных режимах. При интенсивных физических нагрузках в мышцах накапливзетмолочная кислота, способная закислять среду и снижать активность многих ферментов.
Температура. При повышении температуры от 0 до 40 °С активность Ферментов, как правило, повышается (рис. 40). Температурный коэффициент Q10 = 2, что указывает на повышение скорости ферментативной реакции в два раза при изменении температуры на 10 °С. Дальнейшее повышение температуры до 45—55 °С приводит к резкому снижению активности ферментов вследствие тепловой денатурации белка. Все ферменты имеют свою оптимальную температуру, при которой активность их максимальная (для многих ферментов оптимальной является температура 37— 40 °С). Однако имеются и термостабильные ферменты, например миокиназа, активность которой сохраняется при нагревании до 100 °С. При понижении температуры активность ферментов снижается. Тем не менее необратимая денатурация их не происходит, так как в условиях оптимальных температур их активность восстанавливается (примером может служить зимняя спячка животных). Это свойство ферментов используется при замораживании продуктов, а также органов и генетического материала, используемых для трансплантации.
Активаторы и ингибиторы. Для ферментов характерна регуляция их активности специфическими низкомолекулярными веществами и ионами металлов, которые называют эффекторами, модуляторами или регуляторами ферментов. Одни из них способны снижать активность фермента (ингибиторы), другие — повышать ее (активаторы). Такой механизм контроля активности ферментов широко изучается, поскольку имеет большое практическое значение.
В качестве активаторов могут выступать самые разнообразные вещества. Это прежде всего ионы двухвалентных металлов, таких как Mg2+, Zn2+, Mn2+, Co2+, Cu2+, Fe2+, Ca2+. Они вызывают обратимое изменение структуры активного центра. Так, карбоангидраза активируется ионами Zn2+, креатинкиназа — ионами Мg2+; АТФ-аза миозина мышц активируется ионами Са2+, для каталитической активности ферментов дыхательной цепи необходимы ионы Си2+ и Fe2+.
Активация некоторых ферментов может осуществляться путем модификации их молекулы и не затрагивать активный центр фермента. Так, HCI активирует пепсиноген желудочного сока, переводя его из неактивной формы в активную (пепсин). Панкреатическая липаза активируется желчными кислотами.
В качестве ингибиторов часто выступают вещества, близкие по строению к субстратам, которые связываются с активным центром фермента. Ингибирование бывает обратимое и необратимое. При обратимом ингибировании ингибитор легко отделяется от фермента и активность фермента восстанавливается. При необратимом ингибировании ингибитор прочно связывается с ферментом и закрывает доступ субстрата к активному центру.
Процесс ингибирования широко используется для коррекции обменных процессов в медицине и других областях деятельности человека. Лечебный эффект ряда лекарственных препаратов обусловлен их ингибиторным действием на отдельные ферменты. Среди ингибиторов, которые обратимо ингибируют ферменты, выделяют конкурентные и неконкурентные ингибиторы.
Конкурентные ингибиторы имеют структуру, подобную субстрату, и конкурируют с ним за место связывания в активном центре фермента. В случае конкурентного торможения ингибитор присоединяется к ферменту в том же участке, что и субстрат, в результате чего субстрат уже не может соединиться с ферментом. Конкурентное ингибирование обратимо и зависит от концентрации ингибитора и субстрата. При высокой концентрации субстрата такие ингибиторы неэффективны.
Неконкурентные ингибиторы реагируют не с активным центром фермента, а с другой частью его молекулы. Это вызывает изменение структуры активного центра, что нарушает процесс катализа. Действие таких ингибиторов можно устранить только химическим изменением структуры их молекулы. К неконкурентным ингибиторам относятся ионы тяжелых металлов и их органические соединения (ртуть, свинец, мышьяк и многие яды), способные блокировать SH-группы в ферменте и нарушать или полностью подавлять обменные процессы в организме.
