
Глава 5
ИСПОЛЬЗОВАНИЕ АНТИБИОТИКОВ В ЛЕЧЕНИИ БОЛЬНЫХ ОСТРЫМ ПАНКРЕАТИТОМ
«Если в будущем кто-то предложит систему, способную по одному или нескольким лабораторным показателям различать отечную и некротическую формы острого панкреатита, это будет означать решение проблемы».
(M. Sashi, 1993)
Тяжелый острый панкреатит (ОП), согласно критериям классификации Атланты (1992) развивается у 20-25% пациентов с ОП и сопровождается летальностью в 10-20% (В.С. Савельев и соавт., 2000, C.W. Imrie, 2003).
Течение ОП у этих пациентов двухфазное: в первые 10-14 дней превалирует синдром системного воспалительного ответа, а в конце второй недели у 40-70% больных с острым некротическим панкреатитом (ОНП) обычно возникают инфекционные осложнения (M.W. Büchler et al., 2000), хотя инфекционный процесс может иметь место и в более ранние сроки заболевания, и в более поздние (A. Lumsden et al., 1990, H.S. Ho et al., 1997).
Следует учитывать то обстоятельство, что достигнутый сегодня прогресс в лечении больных с ОП связан с тем, что современная интенсивная терапия позволила снизить летальность именно в первую фазу ОП, однако при этом возросла частота развития инфекционных постнекротических осложнений во второй фазе заболевания, (J.P. Neoptolemos et al., 1998), P. Wilson G. et al., 1998). Такие осложнения у 24% больных возникают в конце первой недели заболевания, а у 71% больных в конце третьей недели (B. Gloor et al., 2001, A. Olah et al., 2002).
Летальности при инфекционных осложнениях ОНП и развитии панкреатогенного сепсиса достигает 50-100%, а особого успеха при лечении больных с таким видом патологии добиться никому не удалось (W. Uhl et al., 1995, P. Puolakkainen et al., 1998, K.M. Kramer et al., 1999, S.W. Schmid et al., 1999). Сегодня около 80% летальных исходов при ОП вызваны именно инфекционными осложнениями (В.С. Савельев и соавт., 2000, H.G. Beger et al., 1986, R. Bittner et al., 1987, D.W. Rattner et al., 1992).
Благоприятные условия для развития инфекционных осложнений при ОНП обусловлены наличием некротических тканей, и зависят от масштаба некротического поражения и характера нарушения кровоснабжения тканей (синхронный тромбоз сосудов) (Ю.Т. Кадощук и соавт., 1991, Р.В. Вашетко и соавт., 2000, H.G. Beger et al., 1986, R. Bittner et al., 1987, A. Lumsden et al., 1990, I.J. Fedorak et al., 1992, D.W. Ratner et al., 1992).
Для возникновения инфекционных осложнений ОП необходимо наличие очагов некроза и их вторичное инфицирование. Маршрутами инфицирования при ОП считают: распространение бактерий лимфогенным, гематогенным путями и при рефлюксе из двенадцатиперстной кишки и билиарного тракта (С.А. Шалимов и соавт., 1990, H.G. Beger et al., 2005). Кроме того, С.А. Шалимов и соавт., (1990) не исключают и существования сапрофитной микрофлоры в ткани поджелудочной железы (ПЖ), которая при определенных условиях, по мнению авторов, может становиться вирулентной. Косвенно мнение С.А. Шалимова и соавт. (1990) подтверждают результаты исследований L. De Souza et al., (1996), которые продемонстрировали в экспериментальной модели, что бактерии могут быть выделены из панкреатической ткани уже через 6 часов после индуцирования ОП. Подобные результаты были получены и M. Schwarz et al., (2000). Ими были обнаружены бактерии в ткани ПЖ уже через 6-8 часов от начала ОП. Что это? Проникновение инфекционного агента извне, или обнаружение сапрофитной флоры ПЖ? - остается неясным.
Как бы то ни было, упрощенно декларативная трактовка маршрутов инфицирования ПЖ и парапанкреатической клетчатки сегодня уже не удовлетворяет клиницистов, поскольку она не определяет источников инфекции (О.Е. Бобров, 2000, 2001, C. Wells et al., 1986, J. Lange et al., 1987). Кроме того, при детальном анализе маршрутов инфицирования можно обнаружить целый ряд нестыковок и голословных допущений:
Во - первых: при ОНП небилиарного генеза желчевыводящие пути, как правило, изначально интактны, а билиарная гипертензия и холангит развиваются сравнительно нечасто и по происхождению - вторичны, т.е. возникают вследствие сдавления общего желчного протока головкой ПЖ. Следовательно, априори считать источником инфицирования некротических очагов билиарную систему некорректно.
Во - вторых: рефлюкс дуоденального содержимого в панкреатический проток практически невозможен. Это подтверждается данными О.Е. Боброва (2000), накопленными при выполнении релаксационной зондовой дуоденографии у 97 пациентов. Даже при "тугом" заполнении двенадцатиперстной кишки ни у одного больного не было получено контрастирования протоковой системы ПЖ. Кроме того, эндоскопическая папиллотомия создает, казалось бы, идеальные условия для дуоденопанкреатического рефлюкса, однако в литературе нет сведений о возрастании частоты возникновения ОНП в отдаленные сроки после папиллотомии. И, наконец, инфекция в содержимом двенадцатиперстной кишки встречается сравнительно нечасто.
В - третьих: распространение инфекции по лимфатическим и кровеносным сосудам, хотя и представляется наиболее вероятным, но должно иметь первичный источник.
Наибольшее значение, как источнику инфекции, в настоящее время придают толстой кишке. Сегодня ее рассматривают, как «мотор сепсиса», «банк патогенных микробов» и «сита», позволяющего микробам колонизировать тонкую кишку, а затем попадать сначала в портальный, а затем и в системный кровоток (R. Zapata - Sirvent et al., 1992, F. Moody et al., 1995).
Диагностика инфекционных осложнений острого панкреатита и их прогнозирование
По современным представлениям (Атланта, 1992), основными клинико - морфологическими формами панкреатической инфекции считают: инфицированный некротический панкреатит, инфицированный кистоид и панкреатогенный абсцесс.
Тяжёлый ОП характеризуется наличием органной недостаточности (согласно шкале Ranson ≥ 3 или APACHE II ≥ 8) или местных осложнений, таких, как некроз, абсцесс образование псевдокист (J.H.C. Ranson et al., 1976, S. Tenner et al., 1997, E.L. Bradley, 1993, P. Gotzinger et al., 2002).
Важную роль в правильной оценке эффективности схем лечения играет скрининг больных с обоснованным диагнозом ОНП при условии верификации его клинической формы и обязательной оценке тяжести состояния на основании рекомендуемых шкал (Ranson, Imrie, Apache II и III) и классификационных систем (Атланта, 1992).
Такой подход является основой объективной и “доказательной” трактовки полученных результатов (E.L. Bradley III, 1992, D.L. Wincoll, 1999, G. Glaser et al., 1998). Кроме того, трудную этическую и медицинскую проблему представляет поиск контрольной группы больных, которым изучаемая схема лечения не будет проводиться (H.S. Ho et al., 1997, В.С. Савельев и соавт., 1999, 2000).
Необходимо отметить, что нельзя не учитывать и комплексность проводимого лечения. При этом эффективность каждого из компонентов является значительным фактором во вкладе в конечный результат лечебной программы.
Использование антибиотиков при лечении больных с острым панкреатитом
Использование антибиотиков в лечении больных ОП до настоящего времени остается предметом непрекращающихся дискуссий (Б.Р. Гельфанд и соавт., 1998, В.С. Савельев и соавт., 1998, S. Ho et al., 1997, K.M. Kramer et al., 1999, D.L. Wincoll, 1999). Мнения исследователей, зачастую диаметрально противоположны – от отрицания целесообразности системного применения анитибиотиков (J.P. Sanford et al., 1992, А. Warshav, 1994), до их рутинного назначения всем больным с ОП (А.В.Костырной и соавт., 2000, P.S. Barie, 1996, K.M. Kramer et al., 1999).
Совершенно очевидно, что инфицированные формы ОП и гнойно - воспалительные изменения парапанкреатической зоны являются абсолютным показанием к операции и назначению антибактериальной терапии. Однако своевременная и ранняя диагностика инфицированного ОНП и его дифференциация от неинфицированной формы в большинстве клинических ситуаций затруднены. Именно поэтому встает вопрос о целесообразности, так называемого, «профилактического» применения антибиотиков в фазу «абактериального (стерильного, асептического)» процесса (R. Bittner et al., 1987, I.J. Fedorak et al., 1992, J.J. Powell et al., 1999).
В 70-е годы ХХ века многие исследователи достаточно категорично утверждали, что системное «профилактическое» применение антибиотиков не оказывает никакого положительного воздействия на клиническое течение ОНП (R. Craig et al., 1975, R. Hoves et al., 1975, T. Finch et al., 1976).
Исследования 90-х годов по этому вопросу позволили установить причины того, почему выводы указанных авторов следует признать не соответствующими действительности.
Во - первых: практически все панкреатологи в 70 - 80 - х годах ХХ века антибиотиком выбора считали ампициллин, который, как оказалось, не проникает через панкреатический барьер и не пенетрирует в ткань ПЖ (G. Burns et al., 1986, M. Buchler et al., 1992).
Во - вторых: эффективность антибиотика напрямую зависит от чувствительности микрофлоры очага инфекции к нему, а бактериальный спектр при инфицированном ОНП (Рис. 5.1) - это в основном кишечная флора, устойчивая к ампициллину (S. Gerzof et al., 1987, R. Isenmann et al., 1996).
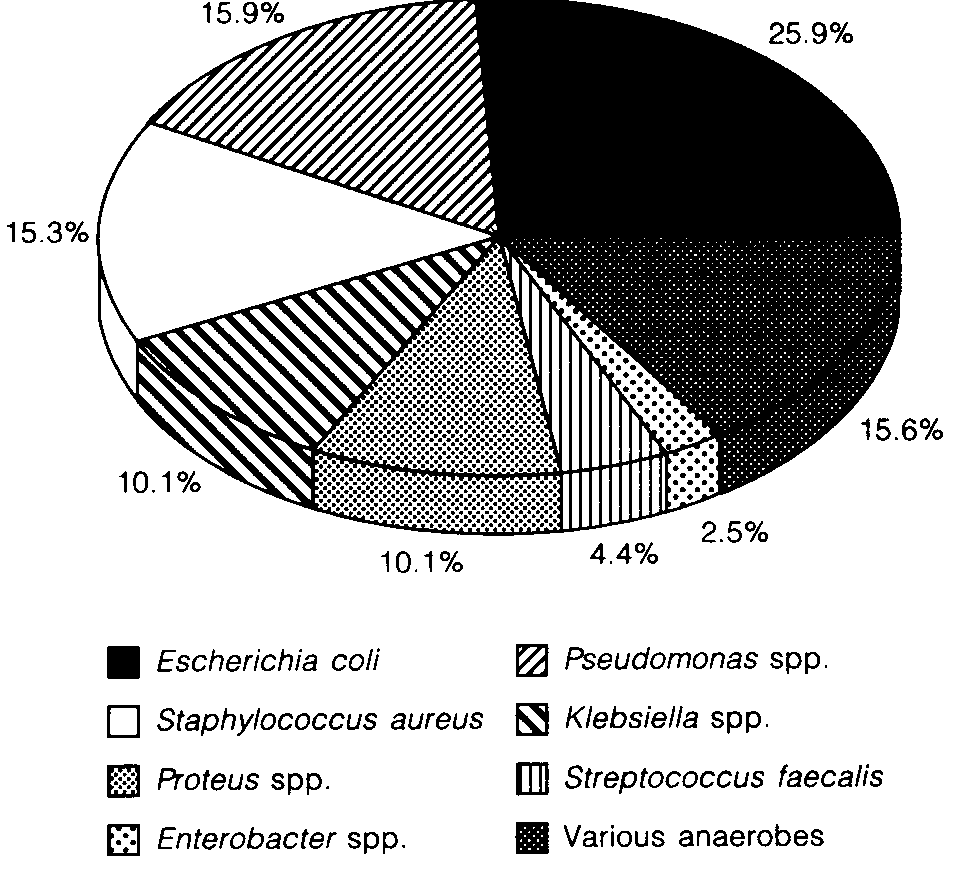
Рис. 5.1. Бактериальный спектр при остром инфицированном некротическом панкреатите (по R. Isenmann et al., 1996).
Эти данные были подтверждены исследованиями конца ХХ века. В итоге было установлено, что наиболее часто инфицирование зон панкреатического некроза (ЗПН) вызывают: E. coli (27–35%), Enterococcus (24–26%), Staphylococcus aureus (14–16%), Staphylococcus epidermidis (15%), Klebsiella (15%) Pseudomonas sp. (7–11%) и Streptococos (4–7%) (R. Bittner et al., 1987, Pederzoli P. et al., 1989, A. Lumsden et al., 1990, D.W. Ratner et al., 1992, P.S. Barie, 1996, C. Bassi et al., 1998, J.J. Powel et al., 1999).
В ХХI веке спектр возбудителей практически не изменился. По сводной статистике, основанной на исследовании 12 авторов наблюдавших более чем 500 больных с ОНП наиболее часто возбудителями инфекционных осложнений являлись: Escherichia coli - 24%, Pseudomonas spp. - 12%, Klebsiella spp . -13%, Proteus spp. - 6%, Citrobacter spp. - 1%, Serratia spp. - 1%, Enterococcus faecalis - 8%, Acinetobacter spp. - 1%, Staphylococcus aureus - 13%, Streptococcus spp. - 9%, Candida albicans - 5%, Bacteroides fragilis - 6% (H.G. Beger et al., 2005).
И, наконец, для выбора режима атибиотикотерапии необходимо учитывать концентрацию препарата в инфекционном очаге, т.е. способность препарата пенетрировать не только ткани здоровой ПЖ, но и в ЗПН (T. Bergan, 1987, R. Isenmann et al., 1996).
Понятно, что при системном назначении эффект возможно ожидать только при использовании антибиотиков достаточно хорошо пенетрирующих в ПЖ. Ясность в этот вопрос внесли результаты исследований M.W. Büchler et al., (1992) по изучению способности пенетрации антибиотика в ткань ПЖ (таблица 5.1).
Таблица 5.1.
Пенетрация антибиотиков в ткань поджелудочной железы (по M.W. Büchler et al., 1992)
Пенетрация антибиотика |
||
Плохая |
Средняя |
Хорошая |
Нетилмицин |
Мезлоциллин |
Ципрофлоксацин |
Тобрамицин |
Пиперациллин |
Офлоксацин |
Ампициллин |
Цефтизоксим |
Имипенем |
|
Цефотаксим |
Метронидазол |
В дальнейшем, исследованиями J.L. Trudel et al., (1994) было установлено, что также хорошо пенетрируют в ПЖ - клиндамицин, метронидазол, хлорамфеникол, цефотаксим и тиенам (имипенем).
Следует отметить, что исследования M.W. Büchler et al., 1992 и J.L. Trudel et al., (1994) только констатировали факт пенетрации антибиотика в ткань ПЖ без учета количественных характеристик фармакокинетики препарата.
Наиболее полно фармакокинетика и количественные характеристики при внутривенном введении антибиотиков у больных с ОНП была изучена R. Isenmann et al., (1996). Тип и дозировка исследованных препаратов представлены в таблице 5.2 .
Таблица 5.2
Тип и дозировка исследованных антибиотиков (по R. Isenmann et al., 1996)
Антибиотик |
Внутривенная дозировка (г) |
Imipenem |
1,0 |
Ceftriaxone |
2,0 |
Cefotaxime |
2,0 |
Ceftizoxime |
2,0 |
Cefotiam |
2,0 |
Piperacillin |
4,0 |
Meziocillin |
4,0 |
Ciprofloxacin |
200 mg |
Ofloxacin |
200 mg |
Tobramycin |
80 mg |
Netilmicin |
150 mg |
Metronidazole |
500 mg |
Для оценки клинической эффективности препарата авторы сравнили отношение средний концентрации антибиотика в ткани ПЖ к средней концентрации препарата в сыворотке крови и рассчитали коэффициент проникновения препарата в ПЖ (Таблица 5.3).
Кроме того, был рассчитан "фактор эффективности", который учитывал: концентрацию антибиотика через 120 минут после введения в ткани ПЖ, спектр бактерий из инфекционного очага в ПЖ, подавление антибиотиком обнаруженных микроорганизмов. В идеале "фактор эффективности" при оптимальном выборе препарата составил бы 1,0, что свидетельствовало бы о полном подавлении всех бактерий в ПЖ. Результаты исследования "фактора эффективности" по R. Isenmann et al., (1996) представлены в таблице 5.4.
Таблица 5.3.
Средние концентрации антибиотиков в панкреатической ткани и коэффициент проникновения препарата в поджелудочную железу (по R. Isenmann et al., 1996)
Препарат |
Средняя концентрация в ткани ПЖ, (мг/кг) |
Средняя концентрация в ткани ПЖ/Средняя концентрация в крови |
Ceftriaxone |
23,6 (7,2-61,9)* |
0,33 (0,08-1,0) |
Piperacillin |
22,5 (2,2-56,0) |
0,49 (0,07-0,60) |
Meziocillin |
19,0 (3,2-37,4) |
0,27 (0,04-1,08) |
Cefotiam |
9,1 (1,3-36,0) |
0,53 (0,3-2,0) |
Cefotaxime |
8,4 (1,0-32,9) |
0,32 (0,05-0,49) |
Ceftizoxime |
7,3 (1,3-19,0) |
0,32 (0,04-0,53) |
Imipenem |
6,0 (1,6-9,9) |
0,43 (0,32-1,21) |
Metronidazole |
3,8 (1,0-13,0) |
0,5 (0,23-1,22) |
Ofloxacin |
1,4 (0,8-2,9) |
0,87 (0,72-1,38) |
Ciprofloxacin |
0,9 (0,4-2,1) |
1,0 (0,5-1,5) |
Tobramycin |
0,5 (0,1-1,4) |
0,12 (0,04-1,08) |
Netilmicin |
0,4 (0,3-0,8) |
0,14 (0,06-0,27) |
*Диапазоны исследованных величин приведены в круглых скобках.
Таблица 5.4.
Факторы эффективности антибиотиков (по R. Isenmann et al., 1996)
Антибиотик |
Фактор эффективности |
Imipenem |
0,98 |
Ofloxacin |
0,87 |
Ciprofloxacin |
0,86 |
Ceftriaxone |
0,79 |
Cefotaxime |
0,78 |
Ceftizoxime |
0,76 |
Cefotiam |
0,75 |
Piperacillin |
0,72 |
Meziocillin |
0,71 |
Tobramycin |
0,22 |
Netilmicin |
0,21 |
В результате проведенных исследований были сформулированы следующие выводы:
1. Imipenem, ciprofloxacin и ofloxacin - являются препаратами выбора, а их "фактор эффективности" близок к оптимальной величине.
2. Антибиотики широкого спектра - цефалоспорины (ceftriaxone, cefotaxime, ceftizoxime, cefotiam) и acylureidopenicillins (piperacillin, meziocillin) - накапливаются в панкреатической ткани в достаточной терапевтической концентрации, но не воздействуют на весь спектр бактерии, характерных для инфекционных очагов в ПЖ.
3. Концентрация в ткани ПЖ таких антибиотиков, как ofnetilmicin, и tobramycin были крайне низкими, поэтому их применение нецелесообразно.
4. Metronidazole - лекарственное средство, высокоактивное против анаэробных микроорганизмов, накапливается в ПЖ в достаточной концентрации, поэтому его применение при лечении больных с ОНП оправдано.
Кроме того, исследованиями 90-х годов было установлено, что концентрация антибиотика в ткани ПЖ зависит от многих факторов: свойств самого антибиотика, анатомических и физиологических особенностей ПЖ, щелочного или кислого pH, концентрации ионов, степени нарушения ферментативной и гормональной регуляции, степени нарушений капиллярного кровотока в органе, объема патологических изменений ПЖ и вида инфекции (M.W. Büchler et al., 1992, T. Foitzik et al., 1997).
В исследованиях B. Drewelow et al., (1993), J.J. Powell et al., (1998) было показано, что достаточно высокая концентрация карбапенемового антибиотика имипенема в тканях ПЖ при отечном ОП по мере развития ОНП уменьшается до уровня ниже бактерицидной. Концентрация цефотаксима даже в стадии отека ПЖ была крайне низкой. Хотя в некротических тканях у больных ОНП были обнаружены все испытываемые антибактериальные препараты, только концентрация пефлоксацина, цефтазидима и метронидазола превышала МПК для наиболее часто идентифицируемой микрофлоры. При этом концентрация мезлоциллина и имипенема могла быть повышена при повторном введении.
Исследования следующих лет были направлены на изучение фармакодинамики антибиотиков в зоны панкреатического некроза.
Так, J. Spicák et al., (1999) была изучeна в эксперименте пенетрация 5 антибиотиков в ткань ПЖ у крыс с ОНП Было выяснено, что цефоперазон (цефалоспорин 3 поколения) и офлоксацин имеют равную пенетрацию, как в ЗПН, так и в неповрежденную ткань ПЖ, в то время как амоксициллин с клавулоновой кислотой, пиперациллин и амикацин демонстрировали недостаточную пенетрацию. Был сделан важный вывод, что пенетрация антибиотика не зависит от наличия или отсутствия ЗПН.
В зависимости от различной пенетрирующей способности в ткани ПЖ в 90-е годы ХХ века выделяли три группы антибактериальных препаратов (M. Buchler et al., 1992, J.J. Powell et al., 1999).
Группа А. Не пенетрирует в ПЖ и не создает минимально-подавляющей концентрации (МПК) для большинства возбудителей: (Аминогликозиды, аминопенициллины, цефалоспорины I поколения).
Группа В. Пенетрирует в ПЖ и создает МПК для некоторых возбудителей: (Мезлоциллин, пиперациллин, цефалоспорины III поколения (цефтизоксим, цефотаксим, цефтазидим).
Группа С. Пенетрирует в ПЖ и создает МПК для большинства возбудителей (Фторхинолоны, карбапенемы).
Следует ли использовать антибиотики при лечении больных острым панкреатитом?
Некоторые авторы отмечают уменьшение частоты инфицирования ЗПН при системной антибиотикотерапии с 67-70% до 32-20% (P.A.Banks et al. 1995, В. Ho H.S. and Frey C.F., (1997), Ф. Саенко, 1997), в то время как другие (J.P. Sanford et al., 1992) такого эффекта не отмечали.
Этим обусловлено то, что вопросы, касающиеся сроков назначения антибиотиков, выбора препарата, режима его использования, до настоящего времени остаются предметом непрекращающихся дискуссий. Мнения исследователей неоднозначны, а зачастую противоположны. Известны, как указания на целесообразность рутинного системного применения антибиотиков (P.S. Barie, 1996, K.M. Kramer et al., 1999), так и отрицание их эффективности при ОП (А. Warshav, 1997).
Умеренные позиции занимают C. Bassi et al., (1994), V. Sainio et al., (1995), H.S. Ho et al., (1997), О.Е. Бобров и соавт., (2005, 2007), А.В.Костырной и соавт., (2000) которые приводят данные о том, что использование антибиотиков при ОНП способствовало только снижению частоты инфекционных осложнений, но никак не влияло на послеоперационную летальность.
Режимы применения антибиотиков
Системная антибиотикопрофилактика и антибиотикотерапия у больных с острым панкреатитом
На сегодняшний день в хирургической практике существуют два тактических подхода к системному применению антибактериальных препаратов — т.н. «профилактический» и «лечебный» (B.A. Cuncha et al., 1997, G. Glazer. et al., 1998, D.H. Wittmann et al., 1998, В.С. Савельев и соавт., 2000).
С «профилактической» целью антибактериальные препараты назначают больному ОНП еще до объективно доказанной контаминации и инфицирования ЗПН в связи с высоким риском развития постнекротических инфекционных осложнений. Эмпирическая «профилактическая» терапия предполагает назначение антибиотиков при наличии клинических признаков инфекционного процесса еще до микробиологического подтверждения, а иногда и в отсутствие возможности для достоверного выявления внутрибрюшинного инфекционного процесса.
Целенаправленную – лечебную антибактериальную терапию проводят после идентификации возбудителя и определения его чувствительности к антибиотикам (Д.Л. Мищенко и соавт., 2002)..
Результаты проспективных рандомизированных исследований конца ХХ начала ХХI века показали, что «профилактическое» применение антибактериальных препаратов при ОНП клинически обосновано (E. Bradley III, 1996).
Это позволило Американскому колледжу гастроэнтерологов в свои рекомендации включить положение о целесообразности, как можно более раннего начала системной антибактериальной терапии при ОП (J.J. Powell et al., 1998). Тем не менее, некоторые хирурги упорно продолжали дискуссию о целесообразности «антибитикопрофилактики» при деструктивных формах ОП.
В частности, P. Barie, (1996) на основании анализа данных литературы пришел к выводу о недостаточной обоснованности и скудности информации, касающейся выбора рационального режима «профилактической» антибиотикотерапии при ОП. Другим аргументом противников «профилактического» назначения антибиотиков остается указание на опасность развития полирезистентных штаммов бактерий и развитие «суперинфекции».
С появленьем дополнительных экспериментальных и клинических данных о патогенезе панкреатической инфекции, фармакодинамике и фармакокинетике современных антибактериальных препаратов эта проблема получила новое развитие (E.L. Bradley III, 1989, B. Drewelow еt al., 1993, K. Koch et al., 1993, C.T. Foitzik et al., 1995, L. Gianotti et al., 1995, Т. Bassi et al., 1998). Сложность в принятии однозначного решения обусловлена еще и тем, что не все опубликованные и широко цитируемые исследования соответствуют требованиям современной доказательной медицины, а некоторые вообще некорректны. Так, в СНГ наиболее известно, и, наиболее часто цитируемо, исследование клиники факультетской хирургии РГМУ, основанное на анализе результатов лечения 89 больных с ОНП (В.С. Савельев и соавт., 2000). Авторами был проведен сравнительный анализ эффективности трех режимов антибиотикотерапии.
В первом режиме работы были использованы аминогликозиды в сочетании с полусинтетическими пенициллинами или линкозамидами и цефалоспорины I поколения. Критерии выбора препарата авторы определяли спектром идентифицированной микрофлоры, т.е. антибиотики применяли при уже наступившем инфицировании (NB!).
Во время второго режима - антибиотикопрофилактику и антибиотикотерапию проводили с использованием внутривенного пути введения, при этом в качестве первоочередных препаратов применяли аминогликозиды + полусинтетические пенициллины или линкозамиды или цефалоспорины I поколения + аминогликозиды + метронидазол. Препаратами резерва являлись цефалоспорины II и III поколения или фторхинолоны (ципрофлоксацин, офлоксацин), что в совокупности позволяло проводить динамическую смену двух или трех режимов антибиотикотерапии. Заметим, что при втором режиме антибиотики применяли, как при неинфицированном, так и при инфицированном ОНП.
В третьем режиме для антибактериальной терапии использовали антибиотики резерва: тиенам в дозе до 3 г/сутки. Такой режим, по мнению авторов, позволял создать максимальную концентрацию препарата в ткани ПЖ, превышающую МПК для большинства возбудителей инфекционных осложнений ОНП. В третьем режиме авторы вообще не указали при каких формах ОНП применяли антибиотики.
Результаты, полученные В.С. Савельевым и соавт., (2000), по их мнению, свидетельствовали – «…о снижении частоты инфекционных осложнений при применении тиенама с отчетливой тенденцией к преимущественному формированию локализованных форм инфекции в виде панкреатического абсцесса. Уровень летальности при первом и втором режиме антибиотикотерапии достигал 50% и 38% соответственно, а при третьем не превышал 10%». Авторы сделали вывод, что использование антибиотикопрофилактики и антибиотикотерапии у больных с ОНП достоверно снижает уровень летальности, а решающее значение при их проведении имеет выбор препарата. Неудачи же антибиотикотерапии они связали с использованием малоэффективных в конкретной ситуации препаратов. Совершенно очевидно, что результаты, полученные В.С. Савельева и соавт., (2000) не могут быть признаны доказательными ввиду некорректного дизайна исследования.
Дополнительным аргументом в пользу проведения ранней антибиотикопрофилактики может служить недавнее рандомизированное исследование, выполненное G. Manes et al., (2006). Пациентов с ОП рандомизировали в группу (n = 108), в которой антибиотик назначали сразу при поступлении в стационар до установления наличия некроза. Во второй группе (n = 107) пациенты получали антибиотик только после верификации некроза. Для установления некроза всем пациентам в течение 48 ч проводили КТ. У пациентов первой группы антибиотик отменяли при установлении отечной формы заболевания. Ранняя антибиотикопрофилактика ассоциировалась со снижением случаев инфекционных осложнений.
Определенный интерес представляют данные анкетирования 429 хирургов - панкреатологов Ассоциации хирургов Великобритании и Ирландии, проведенного в 1997 г., по вопросам антибиотикопрофилактики при ОП (J.J. Powel et al.). Установлено, что при ОП антибиотикопрофилактику проводили 88% респондентов. Причем, 24% хирургов применяли антибиотики у вех больных с ОП, хотя известно, что такая терапия бессмысленна при абортивных его формах. В остальных наблюдениях выбор антибактериального препарата был строго обоснован подтвержденьем прогностически тяжелого течения заболевания — развитием ОНП. На этом фоне у 72% с ОНП хирурги отдавали предпочтение цефалоспоринам — цефотаксиму и цефтриаксону (III поколение) цефрадину (I поколение), однако наиболее часто (46%) использовали цефалоспорин II поколения цефуроксим. Комбинированная терапия с применением метронидазола была проведена в 48% наблюдений. Ко - амоксиклав был использован у 13% больных, тогда как карбапенемы (имипенем и меропенем) — только у 5% больных. Фторхинолоны, гентамицин и аминопенициллины, пиперациллин и пиперациллин/тазобактам применяли одинаково часто — в 2% наблюдений.
По мнению P. Puolakkainen и соавт., (1998), в качестве первоначального режима профилактики при ОНП целесообразно использовать цефуроксим, как препарат с “нешироким” спектром действия, но, доказанной в клинических рандомизированных контролированных исследованиях, эффективностью, тогда как в поздние сроки рекомендовано применение комбинаций препаратов (имипенем + ванкомицин) (V. Sainio et al., 1995). Такую тактику обосновывают достоверным сниженьем частоты инфекционных осложнений ОНП и уменьшением летальности, уменьшеньем риска развития грибковой суперинфекции и приемлемым соотношеньем стоимость—эффективность (G. Glazer et al., 1998). Однако ограниченный спектр антибактериальной активности в отношении псевдомонад, энтерококков и энтеробактера, отсутствие данных о проникновении цефуроксима в ткани ПЖ считают недостатком препарата, как первоочередного режима антибиотикопрофилактики при ОНП (D.H. Wittmann et al., 1998).
По современным представлениям препаратами выбора при ОНП считают цефалоспорины III поколения, пиперациллин, фторхинолоны, фторхинолоны, карбапенемы и метронидазол (P. Pedersoli et al., 1993, C. Bassi et al., 1994, 1998, V. Sainio et al., 1995, E.L. Bradley, 1996, P.S. Barie, 1996, R. Delcenserie et al., 1996, H.S. Ho et al., 1997).
Ципрофлоксацин и офлоксацин активны в отношении грамотрицательных бактерий, включая Pseudomonas spp. Вместе с тем их активность в отношении грамположительной и анаэробной микрофлоры недостаточна. Существует мнение, что парентеральные формы ципрофлоксацина слишком дороги, чтобы использовать их как средство профилактики (J.J. Powel et al. 1998).
При выборе цефалоспоринов III поколения следует учитывать определенные особенности их воздействия. Так, цефтриаксон может вызывать образование нерастворимых желчных солей, способствуя тем самым сладжу в желчной системе (J.J. Powel et al. 1998).
Мощным антимикробным потенциалом в отношении панкреатической инфекции обладают фторхинолоны, однако, C. Bassi и соавт. (1998) в рандомизированных проспективных исследованиях показали, что при ОНП профилактика имипенемом (по 500 мг 3 раза в сутки) имеет существенные преимущества, выражающиеся в снижении частоты инфекционных осложнений по сравнению с использованьем пефлоксацина (по 400 мг 2 раза в сутки).
Уреидопенициллины (пиперациллин, мезлоциллин) имеют широкий спектр антибактериальной активности, охватывающий псевдомонады, энтерококковую и анаэробную микрофлору. Вместе с тем стоимость этих препаратов также высока (J.J. Powel et al. 1998).
Антибиотики карбапенемовой группы (имипенем/циластатин и меропенем) обладают широким спектром активности в отношении грамположительных и грамотрицательных аэробов и анаэробов с хорошей пенетрацией даже в некротические ткани ПЖ (P. Pedersoli et al., 1993, E.E. Bradley et al., 1996, C. Bassi et al., 1994, 1998). Так, ретроспективный анализ результатов лечения 75 больных ОНП показал, что терапия имипенем/циластатином (в/в по 500 мг 3 раза в сутки) сопровождалась достоверным сниженьем частоты инфекционных осложнений с тенденцией к уменьшению летальности по сравнению с контролем (H.S. Ho et al., 1997). К сожалению, высокая стоимость карбапенемов затрудняет их широкое использование, как профилактического средства при ОНП (J.J. Powel et al. 1998).
Результаты рандомизированных клинических исследований системного использования антибиотиков
В клиническом исследовании C. Bassi et al., (1998) сравнивались 2 группы по 30 пациентов каждая, пациенты первой получали пефлоксацин, второй – имипенем. Снижение частоты развития инфицирования ЗПН наблюдалось в группе имипенема (3 × 10, p = 0.034). Разницы в показателях летальности не наблюдалось (10% против 24%), (p = 0.18). Это исследование показало, что пефлоксацин менее эффективен, чем имипенем в клинической практике. Хотя не было исследований, сравнивающих эффективность ципрофлоксацина и имипенема, можно предположить,что антибиотики данного класса менее эффективны, чем имипенем.
В исследовании, проведённом I. Nordback et al., (2001) были отмечены преимущества раннего назначения имипенема у пациентов с ОНП в сравнении с более поздним.
В рандомизированном клиническом исследовании относительно использования антибиотиков в лечении больных ОП, проведённом P. Pederzoli et al. в 1993 году, принимали участие 74 пациента с тяжёлым ОП в 6 медицинских центрах Италии. Пациенты были разделены на 2 группы: контрольную (33 чел.) и группу, получавшую в течение 14 дней имипенем 500 мг 3 раза в сутки в/в – 41 чел. У пациентов, получавших антибиотик, наблюдалось снижение частоты панкреатического сепсиса (30.3% в сравнении с 12.2%, p < 0,01). Однако достоверного снижения летальности в группе имипенема авторы не наблюдали (12% против 7%).
В 1995 году было проведено другое исследование V. Sainio et al., в котором принимали участие 60 пациентов с тяжёлым ОП. Одна из групп принимала цефуроксим 3 раза по 1,5 мг в сутки в/в. Было обнаружено снижение числа случаев инфицирования ЗПН (36 против 8, p = 0,012) и летальных исходов (7 против 1, p = 0,028) в группе цефуроксима. Однако у 66,7% пациентов из этой группы на протяжении лечения изменялся антибиотик. Более того, 23 из 30 пациентов в контрольной группе получали антибиотик в течение 6 дней после начала исследования. Выводом авторов стало утверждение, что использование цефалоспоринов остается дискутабельным вследствие низкой панкреатической пенетрации.
R. Delcenserie et al. в 1996 году было проведено перспективное исследование с участием 23 пациентов с алкогольным тяжёлым ОП. Они были разделены на 2 группы: контрольную и получавшую цефтазидим 3×2г в/в, амикацин 2×7,5 мг/кг в/в и метронидазол 3×500 мг в/в в течение 10 дней. Было обнаружено снижение частоты инфекционных осложнений в группе, получавшей антибиотики (7 против 0, p = 0,03), но разницы в уровне летальности между двумя группами авторы не наблюдали.
В другом клиническом исследовании описано снижение частоты инфекционный осложнений в группе из 29 пациентов, которым были назначены офлоксацин и метронидазол (7% против 46%) - (M. Schwarz et al., 1997).
Таким образом, исследования P. Pederzoli et al., (1993), R. Delcenserie et al., (1996) и M. Schwarz et al., (1997) продемонстрировали снижение частоты инфекционных осложнений при ОП, но не снижение летальности у пациентов, принимавших антибиотики (таблица 5).
Только в результатах исследования V. Sainio et al., (1995) идёт речь о снижении летальности при использовании антибиотиков.
Таблица 5.5.
Клинические исследования, сравнивающие использование антибиотиков и плацебо
Авторы |
Лечение |
Пациенты (кол-во) |
Инфицированный некроз (%) |
Летальность (%) |
Р. Pederzoli et al. (1993) |
Имипенем |
41 |
12* |
7 |
Плацебо |
33 |
30 |
12 |
|
V. Sainio et al., (1995) |
Цефуроксим |
30 |
30 |
3 |
Плацебо |
40 |
30 |
23 |
|
R. Delcenserie et al., (1996) |
Цефтазидин+ Амикацин+ Метронидазол |
11 |
0 |
0 |
Плацебо |
33 |
12 |
25 |
|
M. Schwarz et al. (1997) |
Оофлоксацин+ Метронидазол |
62 |
13 |
0 |
Плацебо |
54 |
13 |
15 |
В 2004 году немецкими учёными «the Ulm group» были опубликованы результаты перспективного рандомизированного двойного слепого плацебо-контролированного исследования о системном использовании антибиотиков в лечении больных ОП (R. Isenmann et al., 2004). В нём принимали участие 114 пациентов, из которых 58 получали антибиотики (ципрофлоксацин 2 × 400 мг в сутки в/в + метронидазол 2 × 500 мг в сутки в/в) и 56 – плацебо. Если у пациента возникали: синдром системного воспалительного ответа, органная недостаточность или любой вид инфекции, пациент прекращал участие в исследовании с открытым протоколом лечения антибиотиками.
Результаты исследования показали, что назначение антибиотиков не снижает развитие инфицирования ЗПН (12% при использовании антибиотиков против 9% при использовании плацебо) и летальность (5% - группа антибиотиков и 7% - контрольная). Однако, 28% пациентов из группы, получавших антибиотики, имели открытый протокол лечения, в сравнении с 46% в контрольной группе. Более того, время открытия протокола в группе получавших антибиотики составляло 11,5 дней и 5 дней в контрольной. Таким образом, согласно данному исследованию, логично предположить, что раннее назначение антибиотиков предпочтительнее. Такого же мнения придерживались и другие авторы (Bassi C. et al., 2004, Pezzilli R. 2004). Несмотря на полученные результаты, вопрос о системном назначении антибиотиков при лечении больных ОП ещё открыт (C.W. Imrie, 2003, S.W. Ashley et al., 2001).
Продолжительность системной антибиотикотерапии
Нет исследований, точно определивших необходимую длительность антибиотикотерапии. Большинство авторов в 90-е годы ХХ века считали, что длительность антибиотикопрофилактики и антибиотикотерапии при ОНП зависит от комплекса факторов, определяющих риск развития инфекционных осложнений: масштаб некротического поражения ПЖ и парапанкреатического пространства, сроки инфицирования “стерильных” тканей от начала заболевания в ЗПН, характер и время хирургического вмешательства (H.G. Beger et al., 1986, H.S. Ho et al., 1997, P.G. Wilson et al., 1998, C. Bassi et al., 1998, P. Puolakkainen et al., 1998, K.M. Kramer et al., 1999). В этой связи длительность применения антибиотиков широко варьировала — от 5 до 30 сут — и предполагали смену 2—3 антибактериальных режимов (P. Pedersoli et al., 1993, G. Glazer et al., 1998, K.M. Kramer et al., 1999).
Согласно рекомендациям консенсусов последних лет, системно антибиотики следует назначать на период от 10 до 14 дней (Д.Л. Мищенко и соавт., 2002, J. Toouli et al., 2002, C. Bassi et al., 2003, T.E. Clancy et al., 2005). После этого периода необходимость дальнейшего их использования определяется индивидуально.
Осложнения при системном назначении антибиотиков для лечения больных острым панкреатитом
Главными аргументами противников рутинного системного использования антибиотиков у больных с ОП являются увеличение числа микозов и повышение бактериальной резистентности, с тенденцией к росту числа Грам+ бактерий (C.W. Imrie, 2003).
Грибковые поражения ПЖ (микозы, кандидозы) развиваются у 12 - 20% больных с инфицированным ОНП и повышают летальность в 1,4 - 2,2 раза (G. Farcas et al., 1998, M. Grewe et al., 1999). Микоз ПЖ развивается, обычно, на 20 - 23 сутки от момента возникновения ОП, а факторами риска его развития являются: антибиотикотерапия, инвазивный мониторинг, интестинальный зонд, лечение стероидными препаратами. В 20% исследований резекционного материала из некротической железы выявляли грибковое инфицирование, которое сопровождалось наличием кандидемии. В литературе описаны случаи, когда фунгальная инфекция была определена как основной фактор, повлиявший на исход заболевания (M. Grewe et al., 1999).
Рандомизированных исследований относительно антигрибковой терапии у этих пациентов касательно того, может ли профилактическое назначение предотвратить грибковую инфекцию и снизить летальность, пока не проведены. Хотя известно, что профилактическое назначение флуконазола снижало частоту кандидозной инфекции в ретроспективном исследовании, но не влияло на летальность. Также, до сих пор, не установлена степень пенетрации в ткани ПЖ для антигрибковых препаратов (И.П. Шлапак и соавт., 2004, J. Mayerle et al., 2004, K. Takeda et al. 2006).
Другие исследователи придерживаются иной точки зрения. Так, согласно исследованию B. Gloor et al., (2001) у 103 пациентов с ОНП, которые получали антибиотики имипенем или циластатин, даже вовремя назначенная антимикотическая терапия не повлияла на прогноз заболевания. По данным J.J. De Waele et al., (2005), полученных при обследовании 46 пациентов с инфицированным ОНП, получавших антибиотики - у 17% из развилась фунгальная инфекция. Однако тенденции к увеличению летальности в данной группе пациентов авторы не наблюдали.
Как бы то ни было, по современным представлениям большинство панкреатологов считают целесообразным профилактическое назначение противогрибковых препаратов (дифлюкан, флюконазол, амфотерицина В) с 5 - 7 суток от момента заболевания (Д.Л. Мищенко и соавт., 2002, T. Aloia et al., 1994). Кроме того, уже начинают дискутироваться вопросы о целесообразности селективной деконтаминации с противогрибковыми препаратами (M. Naef et al., 1994).
Альтернативные пути антибактериальной терапии
Выделение у больных с инфицированным ОНП микроорганизмов, характерных для колонизационного спектра толстой и тонкой кишки, служит веским основанием для утверждения, что микрофлора желудочно - кишечного тракта в условиях его пареза и повреждения барьерной функции является одним из основных источников инфицирования девитализированной ткани ПЖ и парапанкреатической клетчатки у больных с ОНП (О.Е. Бобров и соавт., 1998, 2005, Б.Р. Гельфанд и соавт., 2002, E.J. Luiten et al., 1995, 1997).
Сегодня показано, что транслокация микрофлоры в очаги некроза ПЖ может происходить трансмурально (трансперитонеально), гематогенным и контактным путем из двенадцатиперстной кишки или билиарных протоков (D.S. Medich et al., 1993, A.L. Widdison et al., 1994, T. Foitzik et al., 1995, L. Gianotti et al., 1995, N.S. Runchel et al., 1995, F. Marotta et al., 1996, , K. Mithifer et al., 1996). Кроме того, процессы транслокации кишечной микрофлоры и системная бактериотоксинемия играют важную роль в патогенезе экстраабдоминальных осложнений ОНП, в частности полиорганной недостаточности (J.J. Powell et al., 1999).
Вышеизложенное является обоснованием альтернативного режима антибактериальной терапии — селективной деконтаминации кишечника (СДК) (L. Gianotti et al., 1995, K. Koch et al., 1993, E.J. Luiten et al., 1995, 1997, F. Marotta et al., 1996, F.B. Cerra et al., 1992). Данные микробиологических исследований кишечного содержимого при ОНП являются основой выбора антибактериальных препаратов, спектр действия которых должен охватывать различные грамотрицательные и грамположительные аэробные и анаэробные микроорганизмы. Это позволяет достаточно точно обосновать эмпирический выбор препарата (О.Е. Бобров и соавт., 2001, 2007). Метод СДК с использованием антибактериальных препаратов у больных хирургического профиля достаточно широко применяют в течение последних 18 - 20 лет (Б.Р. Гельфанд и соавт., 2002, R. Rosher et al., 1988, Mc. P. Clelland et al., 1990, R.Saadia et al., 1990, C.W.M.Tetterro et al., 1992, H.K.F.Van Saene et al., 1998, A. Nathens et al., 1999).
Идея СДК при ОНП соответствует основным стратегическим позициям, лежащим в основе метода профилактики инфекционных осложнений в абдоминальной хирургии (P. Blair et al., 1991, R. D"Amico et al., 1998, J. Flaherty et al., 1990, P. McClelland et al., 1990, J. Godart et al., 1990, A.J. Kerver et al., 1988, B. Misset et al., 1996, H.K. Saene et al., 1989, C.M. Vandenbrouke-Grauls et al., 1991, D. Van der Waaij et al., 1990). Энтеральное применение антибактериальных препаратов при ОНП направлено на элиминацию потенциально патогенной микрофлоры из просвета желудочно-кишечного тракта для предотвращения транслокации бактерий и инфицирования некротических тканей у больного (N.S. Runkel et al., 1991, 1995).
Основной идеологией СДК является устранение именно гастроэнтерогенного источника патологической бактериальной контаминации и предотвращение (ре)инфицирования у больных с учетом минимального воздействия на колонизационную резистентность организма, представленную в первую очередь нормальной эндогенной микрофлорой ЖКТ (D.J. Bihary et F.B. Cerra, 1996, C.M.J.E. Vandenbroucke-Grauls et al., 1991). Это определило главную направленность режима СДК у хирургических больных - профилактику распространения или локальное (селективное) устранение условно-патогенных бактерий и их токсинов из просвета ЖКТ. Следствием этого является "разрыв" основных звеньев патогенеза внутрибрюшных и экстраабдоминальных гнойно-септических осложнений (Б.Р. Гельфанд и соавт., 2002).
Вторым важным обоснованием целесообразности применения режима СДК ЖКТ явились результаты комплексных исследований, показавших роль условно-патогенной микрофлоры ЖКТ, как дополнительного источника эндогенной контаминации и инфицирования у больных с различными формами тяжелого абдоминального сепсиса (Б.Р. Гельфанд и соавт., 2002, D.E. Fry, 1988, J.S. Marshall et al., 1988, J.M.A. Bohnen et al., 1992, E.J.T. Luiten et al., 1998).
Установлено, что развитие «синдрома кишечной недостаточности» (СКН) приводит к нарушению барьерной функции ЖКТ с транслокацией ("перемещением") условно-патогенных микроорганизмов за пределы кишечной трубки ("spillover-effect") (С.З. Бурневич, 1994, Б.Р. Гельфанд и соавт., 2002, J.L. Meakins et al., 1986, G. Bounous, 1990, A.M. Castancio et al., 1990). При этом, эндогенная микрофлора ЖКТ и ее (эндо)токсины поступают, как в брюшную полость и забрюшинное пространство, так и в портальный и системный кровоток, и, пути регионарного лимфооттока (E.A. Deitch, 1987, 1989, 1990, M. Last et al., 1983, C.E Edmiston et al., 1990, D.H. Wittmann, 1991). Именно поэтому составные элементы химуса ЖКТ рассматривают, как "мотор" развития ПОН и инфекционно-токсического (септического) шока, независимо от основной причины нарушения микробиоценоза и моторно-эвакуаторной функции кишечника. По образному выражению J.Meakins и J.Marshall (1986), патологическое содержимое ЖКТ у этих пациентов является фактически "недренируемым абсцессом".
Важным фактором, определяющим направленность СДК является характеристика условно-патогенной микрофлоры ЖКТ. Так, основными возбудителями большинства гнойно-септических осложнений у больных хирургического профиля являются преимущественно микроорганизмы грамотрицательного спектра. Подавляющее большинство этих микроорганизмов имеет "первичное или вторичное" гастроэнтерогенное происхождение. В связи с этим селективная элиминация преимущественно этих бактерий с помощью антибактериальных препаратов, вводимых в просвет желудка и кишечника, позволяет сохранить собственную эндогенную анаэробную микрофлору ЖКТ, которая, как известно, имеет низкий патогенный потенциал в естественных местах своего обитания (D. Van der Waaij et al., 1990).
Препараты для СДК по современным представлениям должны отвечать следующим параметрам (Б.Р. Гельфанд и соавт., 2002):
Низкая всасываемость из просвета ЖКТ, что позволяет создать максимальные концентрации антибиотика в ЖКТ - (аминогликозиды, полимиксины, амфотерицин В).
Возможность создания высокой концентрации препарата в просвете ЖКТ, которые создаются вследствие нарушения всасывательной его функции с развитием СКН и стойкого пареза (фторхинолоны - преимущественно норфлоксацин и пефлоксацин).
Антибактериальные препараты, используемые для СДК должны "перекрывать" практически весь спектр аэробной условно-патогенной микрофлоры ЖКТ.
Повысить эффективность СДК возможно применением энтеральной зондовой декомпрессии, детоксикации и энтеросорбции, за счет устранения объема кишечного химуса.
Препаратами выбора в большинстве клинических исследований считают следующие комплексы:
тобрамицин (гентамицин) – 320 мг/сут
полимиксин Е (колистин) или М – 200–400 мг/сут
амфотерицин В/нистатин – 2000 мг/сут
флуконазол – 50–150 мг/сут.
Альтернативой препаратам из группы аминогликозидов являются фторхинолоны (норфлоксацин, ципрофлоксацин, офлоксацин, пефлоксацин), которые в ряде ситуаций комбинируют с полимиксином М (колистин) (Б.Р. Гельфанд и соавт., 2002, R.D Amico et al., 1998).
норфлоксацин – 1500 мг/сут
ципрофлоксацин – 1000 мг/сут
пефлоксацин – 800–1200 мг/сут.
Повышает эффективность антибактериальной терапии комбинация СДК с системным введением антибиотиков. Этот компонент необходим для того, чтобы на период достижения оптимальной концентрации энтерально вводимых препаратов обеспечить терапевтическую концентрацию антибиотика в системном кровотоке и очагах некротической деструкции в отношении потенциальных возбудителей при эндогенном (ре)инфицировании. Кроме того, парентеральное использование антибиотиков позволяет предупредить колонизацию или инфицирование мочевыводящих путей, респираторного тракта и кожных покровов "госпитальными" микроорганизмами в период стабилизации энтерального компонента СДК (Б.Р. Гельфанд и соавт., 2002, О.Е. Бобров и соавт., 2001, 2007).
Энтерально препараты вводят 4 раза в сутки в назогастральный или назоинтестинальный зонды. При восстановлении функции ЖКТ больной может принимать препараты per os. Ротоглотку и ротовую полость целесообразно обрабатывать гелями или пастами, содержащими 2% комплекс этих же антибактериальных препаратов. Длительность СДК варьирует от 7 сут и более, что определяют индивидуально в соответствии с тяжестью состояния больного, длительностью пареза ЖКТ и катетеризации полых органов, результатами микробиологических исследований в динамике заболевания. Обязательным контролем за проводимым лечением является микробиологический мониторинг не реже 2 раз в 1 неделю.
К концу 90-х годов ХХ века было накоплено большое число данных об эффективности СДК. Следует отметить, что эти данные по мере накопления претерпели определенную эволюцию от скептического отношения до убедительного подтверждения положительного влияния СДК на течение абдоминального сепсиса у больных с ОНП (F. Marotta et al., 1996).
В частности, E. Luiten et al., (1995) провели клинические исследования по изучению эффективности СДК у 107 больных ОНП. При СДК в режиме перорального приема и ректального введения колистина, амфотерицина В и норфлоксацина в сочетании с парентеральным введением цефотаксима, до полной элиминации грамотрицательной микрофлоры из ротовой полости и прямой кишки у 102 больных ОНП было установлено достоверное снижение летальности с 35 до 22% (p < 0,05), при доказательном уровне снижения частоты инфекционных осложнений с 38 до 18% (p < 0,03), и, уменьшения количества повторных операций в основной группе больных. Авторы установили, что СДК у больных ОНП наиболее эффективна при категории тяжести по шкале Glasgow более 3 баллов независимо от масштаба поражения ПЖ по данным компьютерной томографии. У больных, с такой категорией тяжести ОП, летальность была снижена с 55 до 31% (p < 0,05). Важно отметить, что достоверное снижение летальности получено у больных после 2 нед. проводимого комплексного лечения, т.е. в сроки наиболее вероятного развития разнообразных постнекротических инфекционных осложнений ОНП.
Рекомендации современных консенсусов по применению антибиотиков у больных острым некротическим панкреатитом
Большинство исследователей сегодня рекомендуют раннее системное назначение антибиотиков пациентам с ОНП (Таблица 6). Так, по рекомендации Международной ассоциации панкреатологии относительно лечения больных ОП рекомендуют профилактическое назначение антибиотиков широкого спектра действия для уменьшения риска инфицирования, как уровень доказательности А (W. Uhl et al., 2002).
Обзор Cochrane (2003) об использовании антибиотиков при лечении больных ОП утверждает, что несмотря на вариабельность выбора препарата, длительности лечения и методологической ценности клинических исследований, существуют серьёзные доказательства того, что внутривенная профилактическая антибиотикотерапия длительностью 10 - 14 дней снижает риск суперинфекции некротизированной ткани и летальности пациентов с тяжёлым ОП и доказанным ОНП (C. Bassi et al., 2003).
Таблица 5.6.
Рекомендации международных консенсусов по использованию антибиотиков у больных с острым панкреатитом
Консенсус |
Источник |
Рекомендации |
Uhl W. et al., 2002 |
International Association of Pancreatology (Pancreatology) |
Да |
Toouli J. et al., 2002 |
Journal of Gastroenterology and Hepatology |
Да |
Nathens A.B. et al., 2004 |
Crit Care Med |
Нет |
UK working party, 2005 |
United Kingdom (Gut) |
Нет консенсуса |
Clancy T.E. et al., 2005 |
Journal of Gastrointestinal Surgery |
Да |
Werner J. et al., 2005 |
Gut |
Да |
Bassi C. et al., 2003 |
Cochrane |
Да |
Chinese pancreatic disease group, 2005 |
Chinese society of gastroenterology (Chinese Journal of Digestive Diseases) |
Да |
Takeda K. et al., 2006 |
JPN Guidelines for the management of acute pancreatitis |
Да |
Необходимо помнить, что согласно рекомендациям Великобритании относительно лечения ОП, риск инфицирования ОНП очень мал при объеме некроза менее 30% ПЖ (Working Party of the British Society of Gastroenterology; Association of Surgeons of Great Britain and Ireland; Pancreatic Society of Great Britain and Ireland; Association of Upper GI Surgeons of Great Britain and Ireland :UK guidelines for the management of acute pancreatitis).
Следовательно, можно утверждать, что назначение профилактической системной антибиотикотерапии уместно у пациентов с тяжелым ОП с более чем 30% некротически пораженной ПЖ по данным компьютерной контрастной панкреатотомографии, выполненной в течение 48 ч после госпитализации больного, при тяжести состояния больного по шкале Ranson более 3 баллов; наличие двух и более жидкостных объемных образований.
Лучшие результаты были получены при назначении имипенема в дозе 500 мг 3 раза в сутки в/в в течение 14 дней. В качестве альтернативной терапии возможно использование ципрофлоксацина 400 мг 2 раза в сутки в/в в комбинации с метронидазолом 500 мг 3 раза в сутки в/в на протяжении 14 дней.
Вместе с тем, следует помнить, что антибиотикопрофилактика и СДК не меняет сроки развития инфекционных осложнений у больных с ОНП (P.S. Barie, 1996). Только в некоторых исследованиях выявлено достоверное снижение летальности в сравниваемых группах больных с ОНП, в большинстве же публикаций отмечена лишь тенденция к ее снижению. Существенно и то, что в литературе до сих пор, нет сведений, что системное назначение антибиотиков у больных с ОП при отсутствии некроза имеет какие то преимущества.
Список литературы:
Бобров О.Е. Острый послеоперационный панкреатит. – Киев.: Феникс, 2000. – 172 с.
Бобров О.Е., Мендель М.А., Зубаль В.І., Ігнатов І.М. Значення динамічної кишкової непрохідності у виникненнї септичних ускладнень при гострому панкреатиті небіліарного генезу // Шпитальна хірургія. - 2001. - №3. - С. 87 - 91.
Бобров О.Е., Ткаченко О.А., Семенюк Ю.С., Мендель М.А. Панкреатологія на роздоріжжі? // Шпитальна хірургія. - 2002. - №1. - С. 123-132.
Бобров О.Е., Мендель Н.А., Головко Е.Б. и др. Программа энтеральной терапии в комплексном лечении больных с тяжелым острым панкреатитом // Хірургія України. - 2003. - №4(8) - С. 171 - 172.
Бобров О.Е., Мендель Н.А., Бучнев В.И., Игнатов И.Н. Эволюция взглядов на проблему лечения больных острым некротическим панкреатитом // Вісник Української медичної стоматологічної академії - 2005. - том. 5. - Вип. - 1(9) - С. 16 - 18.
Бобров О.Е., Мендель Н.А., Игнатов И.Н. Эволюция лечебной тактики при остром панкреатите // Архив клинической и экспериментальной медицины. – 2007. – том. 16. - №1. – 15 – 19.
Вашетко Р.В., Толстой А.Д., Курыгин А.А., Стойко Ю.М., Краснорогов В.П. Острый панкреатит и травмы поджелудочной железы: руководство для врачей. - Спб.: Питер, 2000. – 320 с.
Гельфанд Б.Р., Бурневич С.З., Брюхов А.Н., Бражник Т.Б. Селективная деконтаминация желудочно-кишечного тракта в интенсивной терапии у больных хирургического профиля // Consilium medicum. – 2002. - №1. - С. 14-18.
Кадощук Ю.Т., Плохой А.А. Профилактика гнойно-некротических осложнений острого панкреатита //Вестн. хирургии им. И.И. Грекова. - 1991. - № 7-8. - С. 123-126.
Костырной А.В. Современные подходы к консервативному лечению гнойно-некротических осложнений острого панкреатита // Клиническая хирургия . – 2000. - №8. - С. 8-10.
Кубышкин В.А., Клыпин А.Б., Шматов В.А. Гнойно-септические осложнения острого панкреатита //Вестн. хирургии им. И.И. Грекова. - 1987. - № 9. - С. 131-135.
Мищенко Д.Л., Васильев Г.А., Бобров О.Е., Шлапак И.П. Инфекция и антибиотикотерапия при тяжелом остром панкреатите // Біль, знеболювання і інтенсивна терапія. – № 2(д). – 2002. – С. 94 - 96. R.
Савельев В.С., Буянов В.М., Огнев Ю.В. Острый панкреатит. М.: Медицина. - 1983. - 240 с.
Савельев В.С., Гельфанд Б.Р., Филимонов М.И. и др. Оптимизация лечения панкреонекроза: роль активной хирургической тактики и рациональной антибактериальной терапии// Анналы хирургии – 2000. - № 2. – С. 12 - 16.
Саенко В.Ф., Ломоносов С.П., Зубков В.И. Антибактериальная терапия больных с инфицированным некротическим панкреатитом // Клин. хирургия. – 2002. - №8. - С. 5 – 8.
Филин В.И. Острые заболевания и повреждения поджелудочной железы. Л.: Медицина. - 1982. - 246 с.
Шалимов А.А., Шалимов С.А., Ничитайло М.Е., Радзиховский А.П. Хирургия поджелудочной железы. - Симферополь.: Таврида. - 1997. - 560 с.
Шалимов С.А., Радзиховский А.П., Ничитайло М.Е. Острый панкреатит и его осложнения. Киев.: Наукова думка. - 1990. - 272 с.
Шлапак И.П., Мищенко Д.Л., Васильев Г.А. Острый панкреатит: профилактика и лечение панкреатической инфекции // Клиническая антибиотикотерапия. – 2004. – №4 (30) – С. 10-14.
Ashley S.W., Perez A., Pierce E.A. et al. Necrotizing pancreatitis – contemporary analysis of 99 consecutive cases //Ann. Surg. – 2001. – vol. 234. – Р. 572 - 580.
Balthazar E.J., Robinson D.L., Megibow A.J., Ranson J.H. Acute pancreatitis: value of CT in establishing prognosis //Radiology. – 1990. - vol 174. – Р. 331 - 336.
Banks P.A., Gerzof S.G., Langenvin R.E. et al. CT-guided aspiration of suspected pancreatic infection //Int. J. Pancreatol. – 1995. – vol. 18. – Р. 265 - 270.
Barie P.S. A critical review of antibiotic prophylaxis in severe acute pancreatitis //Am. J. Surg. - 1996. - vol. 172(6A). – Р. 38 - 43.
Bassi C., Falconi M. Discussion on prophylactic antibiotic treatment in patients with predicted severe pancreatitis: a placebo-controlled, double-blind trial //Gastroenterology. – 2004. – vol. 127. – Р. 1015 - 1016.
Bassi C., Falconi M., Talamini G. et al. Controlled clinical trial of Pefloxacin versus Imipenem in severe acute pancreatitis //Gastroenterology – 1998. - vol. 115. – Р. 1513 - 1517.
Bassi C., Falconi M., Talomini F. Controlled clinical trial of pefloxacin versus. Imipenem in sever acute pancreatitis.// Gastroenterology. - 1998. - V. 115. – p. 1513-1517.
Bassi C., Larvin M., Villatoro E. Antibiotic therapy for prophylaxis against infection of pancreatic necrosis in acute pancreatitis //Cochrane Database Syst. Rev. – 2003. - 4:CD002941.
Beger H.G., Bittner R., Block S., Buchler M. Bacterial contamination of pancreatic necrosis. A prospective clinical study //Gastroenterology. – 1986. - vol. 91. – Р. 433 - 438.
Beger H.G., Rau B., Isenmann R., Schwarz M. et al. Antibiotic prophylaxis in severe acute pancreatitis //Pancreatology. – 2005. - vol 5. – Р. 10 - 19.
Bradley E., Fulenwider J. Open treatment of pancreatic abscess //Surg. Ginec. Obst. - 1984. - vol. 159. - N 11. - P. 509 - 513.
Bradley E.L. A clinically based classification system for acute pancreatitis: summary of the Atlanta symposium //Arch. Surg. – 1993. - vol 128. – Р. 586 - 590.
Büchler M.W., Gloor B., Muller C.A. et al. Acute necrotizing pancreatitis: treatment strategy according to the status of infection //Ann. Surg. – 2000. – vol. 232. – Р. 619 - 626.
Buchler M.W., Malferstheiner P. Acute pancreatitis: Novel concepts in biology and therapy. - Berlin; Vienna: Blackwell Wissen-Schafts-Verlag, 1999. - 548 р.
Büchler M.W., Malfertheiner P., Friess H. et al. Human pancreatic tissue concentration of bactericidal antibiotics //Gastroenterology. – 1992. - vol. 103. – Р. 1902 - 1908.
Clancy T.E., Benoit E.P., Ashley S.W. Current management of acute pancreatitis //J. Gastrointest. Surg. – 2005. - vol. 9. – Р. 440 - 452.
Craig R.M., Dordal E., Myles L. The use of ampicillin in acute pancreatitis //Ann. Intern. Med. – 1975. – № 83. – Р. 831 - 835.
De Waele J.J., Vogelaers D., Blot S., Colardyn F. Fungal infections in patients with severe acute pancreatitis and the use of prophylactic therapy //Clin. Infect. Dis. – 2003. - vol. 37. – Р. 208 - 213. Delcenserie R., Yzet T., Ducroix J.P. Prophylatic antibiotics in treatment of severe acute alcoholic pancreatitis //Pancreas. – 1996. - vol 13. – Р. 198 - 201.
Gloor B., Muller C.A., Worni M. et al. Pancreatic infection in severe pancreatitis : the role of fungus and multiresistant organisms //Arch. Surg. – 2001. - vol 136. – Р. 592 - 596.
Gotzinger P., Sautner T., Kriwanek S. et al. Surgical treatment for severe acute pancreatitis: extent and surgical control of necrosis determine outcome. //World. J. Surg. – 2002. - vol 26. – Р. 474 - 478.
Grewe M., Tsiotos G.G., Luque de Leon E., Sarr M.G. Fungal infection in acute necrotizing pancreatitis //J. Am. Coll. Surg. – 1999. - № 188. – 408 - 441.
Gullo L. Somatostatin analogues and exocrine pancreatic secretion.// Digestion – 1996. - Vol. 57, suppl. 1. - P. 14-19.
Ho H.S., Frey C.F. :The role of antibiotic prophylaxis in severe acute pancreatitis //Arch. Surg. – 1997. – vol. 132. – Р. 487 - 493.
Imrie C.W. Severe acute pancreatitis. Hepatobiliary and Pancreatic Surgery. 1st edition. Edited by: Poston J., Blumgart L. London, UK: Martin Dunitz, 2003. – Р. 393 - 405.

Isenmann R., Beger H.G. Natural history of acute pancreatitis and the role of infection. Bailliere's best practice & research, 1999. – Jul. - 13(2). – Р. 291 - 301.
Isenmann R., Runzi M., Kron M., et al. Prophylactic antibiotic treatment in patients with predicted acute pancreatitis //Eur. J. Clin. Microbiol. Infect. Dis. – 1996. - №15(12). – Р. 913 - 921.
Isenmann R., Runzi M, Kron M. et al. German Antibiotics in Severe Acute Pancreatitis Study Group: Prophylactic antibiotic treatment in patients with predicted severe acute pancreatitis: a placebo-controlled, double-blind trial //Gastroenterology. – 2004. – vol. 126. – Р. 997 - 1004.
Kramer K.M., Wevy H. Prophylactic antibiotics for severe acute pancreatitis: the beginning of an era. // Pharmacotherapy – 1999. - N 19. - P. 592-602.
Manes G., Uomo I., Menchise A. et al. Timing of Antibiotic Prophylaxis in Acute Pancreatitis: A Controlled Randomized Study with Meropenem // Am J Gastroenterol. – 2006. – Vol. 101. – P. 1348-1353.
Mayerle J., Simon P., Lerch M.M. et al. Medical treatment of acute pancreatitis // Gastroenterol Clin N Am. – 2004. – Vol. 33. – P. 855-869.
Mithofer K., Fernandez-Del Castillo C., Ferraro M. et al. Antibiotic treatment improves survival in experimental acute necrotizing pancreatitis //Gastroenterology. – 1996. - vol. 110. – Р. 232 -240. Nathens A.B., Curtis J.R., Beale R.J. et al. Management of the critically ill patient with severe acute pancreatitis //Crit. Care. Med. – 2004. - vol. 32. – Р. 2524 - 2536.
Nordback I., Sand J., Saaristo R., Paajanen H. Early treatment with antibiotics reduces the need for surgery in acute necrotizing pancreatitis – a single-center randomized study //J. Gastrointest. Surg. – 2001. - vol. 5. – Р. 113 - 118.
Olah A., Belagyi T., Issekutz A. et al. Randomized clinical trial of specific lactobacillus and fibre supplement to early enteral nutrition in patients with acute pancreatitis //Br. J. Surg. – 2002. - vol 89. – Р. 1103 - 1107.
Pancreatic Disease Group, Chinese Society of Gastroenterology & Chinese Medical Association :Consensus on the diagnosis and treatment of acute pancreatitis //Chin. J. Dig. Dis. – 2005 - vol. 6. – Р. 47 - 51.
Pederzoli P., Bassi C., Vesentini S., Campedelli A. A randomized multicenter clinical trial of antibiotic prophylaxis of septic complications in acute necrotizing pancreatitis with imipenem //Surg. Gynecol. Obstet. – 1993. - vol 176. – Р. 480 - 483.
Pederzoli P., Falconi M., Bassi C. et al. Ofloxacin penetration into bile and pancreatic juice //Antimicrob. Chemother. – 1989. - vol. 23. – Р. 805 - 807.
Pezzilli R. Antibiotic prophylaxis in acute necrotizing pancreatitis: yes or no? //JOP. - 2004. - vol. 5. – Р. 161 - 164.
Puolakkainen P., Kemppainen E., Leppaniemi A. et al. Current principles of treatment in acute pancreatitis //Ann. Chir. Gynaecol. – 1998. - vol 87. – Р. 200 - 203.
Ranson J.H.C., Rifkind K.M., Turner J.W. Prognostic signs and nonoperative peritoneal lavage in acute pancreatitis //Surg. Gynecol. Obstet. – 1976. - vol 143. – Р. 209 - 219.
Robert J.H., Frossard J.L., Mermillod B. et al. Early prediction of acute pancreatitis: prospective study comparing computed tomography scans, Ranson, Glasgow, acute physiology and chronic evaluation II scores, and various serum markers //World. J. Surg. – 2002. - vol 26. – Р. 612 - 619.
Sainio V., Kemppainen E., Puolakkainen P. et al. Early antibiotic treatment in acute necrotising pancreatitis //Lancet. – 1995. - №346. – Р. 663 - 667.
Schmid S.W., Uhl W., Friess H., Malfertheiner P., Buchler M.W. The role of infection in acute pancreatitis //Gut. – 1999. - vol 45. – Р. 311 - 316.
Schwarz M., Isenmann R., Meyer H., Beger H.G. Antibiotic use in necrotizing pancreatitis. Results of a controlled study //Dtsch. Med. Wochenschr. – 1997. - vol 122. – Р. 356 - 361.
Schwarz M., Thomsen J., Meyer H. et al. Frequency and time course of pancreatic and extrapancreatic bacterial infection in experimental acute pancreatitis in rats //Surgery. – 2000. - vol. 127. – Р. 427 - 432.
Souza L., Sampietre S.N., Figueiredo S. et al. Bacterial translocation in acute pancreatitis //Rev. Hosp. Clin. Fac. Med. Sao Paulo. – 1996. - vol. 51. – Р. 116 - 120.
Spicák J., Martínek J., Závada F. et al. Penetration of antibiotics into the pancreas in rats: an effect of acute necrotizing pancreatitis //Scand. J. Gastroenterol. – 1999. - vol. 34. – Р. 92 - 97.
Takeda K., Takada T., Kawarada Y. et al. JPN Guidelines for the management of acute pancreatitis: medical management of acute pancreatitis //J. Hepatobiliary. Pancreat. Surg. – 2006. - vol. 13. – Р. 42 - 47.
Tenner S., Banks P.A. Acute pancreatitis: nonsurgical management //World. J. Surg. – 1997. - № 21. – Р. 143 - 148.
Toouli J., Brooke-Smith M., Bassi C. et al. Guidelines for the management of acute pancreatitis //J. Gastroenterol. Hepatol. – 2002. - vol. 17(Suppl). – Р. 15 - 39.
Trudel J.L., Wittnich C., Brown R.A. Antibiotics bioavailability in acute experimental pancreatitis //J. Am. Coll. Surg. – 1994. - vol. 178. – Р. 475 - 479.
Uhl W., Warshaw A., Imrie C. et al. IAP guidelines for the surgical management of acute pancreatitis //Pancreatology. – 2002. - vol. 2. – Р. 565 - 573.
Werner J., Feuerbach S., Uhl W., Buchler M.W. Management of acute pancreatitis: from surgery to interventional intensive care //Gut. – 2005. - vol. 54. – Р. 426 - 436.
Werner J., Hartwig W., Uhl W. et al. Useful markers for predicting severity and monitoring progression of acute pancreatitis //Pancreatology. – 2003. - vol. 3. – Р. 115 - 127.
Widdison A.L., Haranjia N.D. Pancreatic infection complicating acute pancreatitis.// Br. I. Surg. – 1993. - N 50. - P. 148-154.
Working Party of the British Society of Gastroenterology; Association of Surgeons of Great Britain and Ireland; Pancreatic Society of Great Britain and Ireland; Association of Upper GI Surgeons of Great Britain and Ireland :UK guidelines for the management of acute pancreatitis //Gut. – 2005. - vol. 54. – Р. 54 – 63.
Wyncoll D.W. The management of severe acute necrotizing: an evidence-based review of the literature.//Intensive Care Med. -1999. - vol.25. - №2. – P. 146 - 156.
