
- •Физические основы классической механики
- •I. Механика. Общие понятия
- •2. Кинематика точки
- •3. Скорость
- •4. Ускорение
- •5. Примеры
- •I. Основные понятия
- •2. Законы механики
- •3. Инерциальные системы отсчёта (и.С.О.)
- •4. Принципы относительности Галилея
- •5. Закон сохранения импульса
- •6. Реактивное движение
- •7. Центр инерции
- •I. Работа
- •2. Энергия
- •3. Кинетическая и потенциальная энергии
- •4. Закон сохранения механической энергии
- •5. Удар абсолютно упругих и неупругих тел
- •I. Кинематика вращательного движения
- •2. Кинетическая энергия вращательного движения. Момент инерции.
- •3. Основное уравнение динамики вращательного движения
- •4. Момент импульса. Закон сохранения момента импульса
- •I. Принцип относительности
- •2. Постулаты Эйнштейна
- •3. Преобразования Лоренца
- •4. Замедление времени
- •5. Сокращение длин
- •6. Сложение скоростей в теории относительности.
- •7. Изменение массы со скоростью
- •8. Движение релятивистской частицы
- •9. Связь между массой и энергией
- •10. Кинетическая энергия. Энергия и импульс
- •Колебания и волны
- •1. Общие сведения о колебаниях
- •2. Механические колебания
- •3. Энергия гармонических колебаний
- •1. Предмет молекулярной физики
- •2. Термодинамические параметры.
- •3. Идеальный газ
- •4. Основное уравнение мкт газов для давления.
- •5. Газовые законы как следствие молекулярно-кинетической теории.
- •1. Скорости теплового движения молекул
- •2. Распределение молекул по скоростям (Закон Максвелла)
- •3. Закон распределения Больцмана
- •4. Число столкновений и средняя длина свободного пробега молекул
- •1. Внутренняя энергия идеального газа
- •2. Первое начало термодинамики
- •3. Работа при расширении газа
- •4. Теплоемкость идеальных газов
- •5. Адиабатический процесс
- •1. Характеристика тепловых процессов.
- •2. Принцип действия тепловой машины
- •3. Второе начало термодинамики
- •1. Энтропия
- •1. Отклонение свойств газов от идеальных.
- •2. Уравнение состояния реального газа (уравнение Ван-дер-Ваальса)
- •1. Критическое состояние вещества
- •1. Внутренняя энергия реального газа
- •1. Жидкости.
- •2. Поверхностное натяжение.
- •3. Явление смачивания.
- •4. Формула Лапласа.
- •5. Капиллярность.
1. Внутренняя энергия идеального газа
Энергия тела складывается из энергии
его движения как целого и внутренней
анергии. Во внутреннюю энергию входят
кинематические энергии частиц тела,
потенциальная энергия взаимодействия.
Для идеального газа потенциальная
энергия взаимодействия молекул мала,
потому внутренняя энергия равна сумме
кинетических энергий отдельных молекул:
![]() .
.
Для одноатомного газа (молекулы состоят
из одного атома, например, инертные
газы) кинетическая энергия молекул
совпадает с энергией их поступательного
движения, которая равна
![]() .
В силу хаотичности движения и равноправия
трех направлений в пространстве
.
В силу хаотичности движения и равноправия
трех направлений в пространстве
![]() ,
поэтому энергия поступательного
движения, приходящаяся на одно из
возможных перемещений или, как говорят,
на одну степень свободы
,
поэтому энергия поступательного
движения, приходящаяся на одно из
возможных перемещений или, как говорят,
на одну степень свободы
![]() ,
равна
,
равна
![]() .
Таким образом, для одноатомных молекул
.
Таким образом, для одноатомных молекул
![]() и
и
![]() (9.1)
(9.1)
Д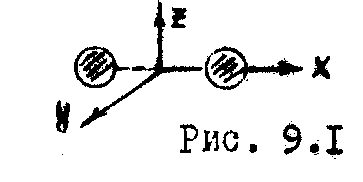
 вухатомные
молекулы (
вухатомные
молекулы (![]() и т.д.) кроме поступательного движения
могут совершать и вращательное движение
вокруг двух осей (y,z)
(Рис. 9.1). Поэтому для них
и т.д.) кроме поступательного движения
могут совершать и вращательное движение
вокруг двух осей (y,z)
(Рис. 9.1). Поэтому для них
![]() .
Одним из основных положений МКТ служит
утверждение, что на любую степень
свободы приходится энергия
.
Одним из основных положений МКТ служит
утверждение, что на любую степень
свободы приходится энергия
![]() .
Поэтому (9.1) справедлива и в этом случае.
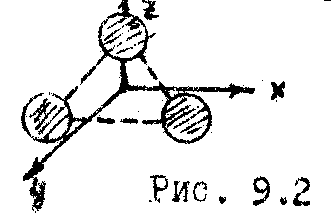
Для трехатомной молекулы (
.
Поэтому (9.1) справедлива и в этом случае.
Для трехатомной молекулы (![]() )
и более сложных (
)
и более сложных (![]() )
)
![]() ,
так как молекула может вращаться вокруг
трёх осей (Рис. 9.2). Итак, с учетом
сказанного, кинетическая энергия молекул
в газе равна
,
а для всего газа из
молекул внутренняя его энергия
будет:
,
так как молекула может вращаться вокруг
трёх осей (Рис. 9.2). Итак, с учетом
сказанного, кинетическая энергия молекул
в газе равна
,
а для всего газа из
молекул внутренняя его энергия
будет:
![]() (9.2)
(9.2)
2. Первое начало термодинамики
Внутренняя энергия тела может изменяться
либо за счет работы, которую над ним
совершают внешние силы, либо за очаг
контакта его с более горячим телом. В
последнем случае, по историческим
причинам, говорят, что к нему подведется
некоторое количество теплоты
![]() .
.
Таким образом, количество теплоты представляет собой энергию, которая передается от одного тела к другому при их контакта , и измеряется в единицах энергии. Кроме того, может измеряться и во внесистемных единицах – калориях(кал). Одна калория равна количеству теплоты, необходимому для нагревания 1 г воды от 19,5 до 20,5°С.
Специальными опытами (Джоуль, Майер, Гирн и др.) установлено, что 1 кал = 4,186 Дж.
Так как работа внешних сил равна убыли
внутренней энергии
![]() ,то
связь между изменением внутренней
энергии
,то
связь между изменением внутренней
энергии
![]() переданным ей количествен тепла
переданным ей количествен тепла
![]() и произведенной системой работы
и произведенной системой работы
![]() описывается уравнением
описывается уравнением
![]() (9.5)
(9.5)
Это уравнение выражает важнейший закон природы - закон сохранения энергии применительно к механической и тепловой энергии. Этот закон получил название первого начала термодинамики.
3. Работа при расширении газа
Р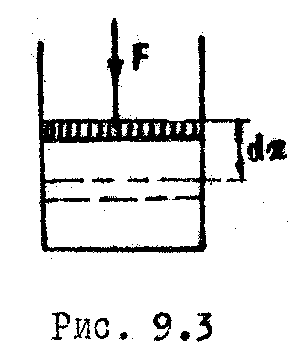 ассмотрим
газ под поршнем в цилиндрическом сосуде
(Рис. 9.3). При перемещении поршня на
ассмотрим
газ под поршнем в цилиндрическом сосуде
(Рис. 9.3). При перемещении поршня на
![]() внешняя сипа
совершает работу
внешняя сипа
совершает работу
![]() ,
где
- давление на поршень,
,
где
- давление на поршень,
![]() - площадь поршня. Эта формула определяет
элементарную работу, если
- площадь поршня. Эта формула определяет
элементарную работу, если
![]() .
Графически работа изображается площадью
ограниченной кривой процесса изменения
объёма (Рис. 9.4). Полная работа при этом
равна:
.
Графически работа изображается площадью
ограниченной кривой процесса изменения
объёма (Рис. 9.4). Полная работа при этом
равна:
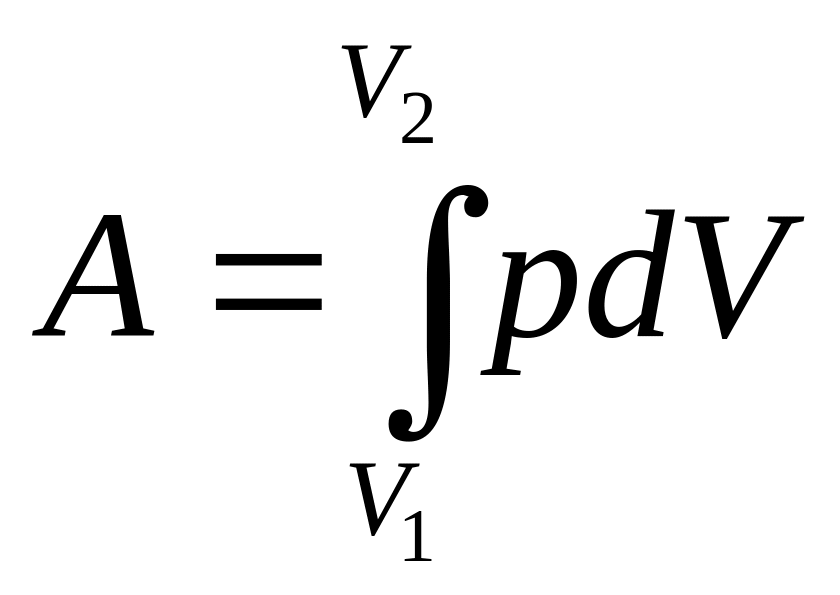
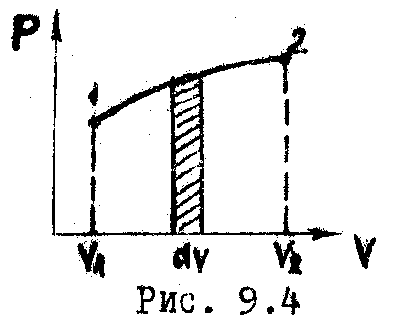 (9.4)
(9.4)
Пользуясь (9.4), вычислим работу газа при расширении в различных процессах.
При изохорическом процессе
![]() ,
поэтому
,
поэтому
![]() .
.
При изобарическом процессе
![]() и
и
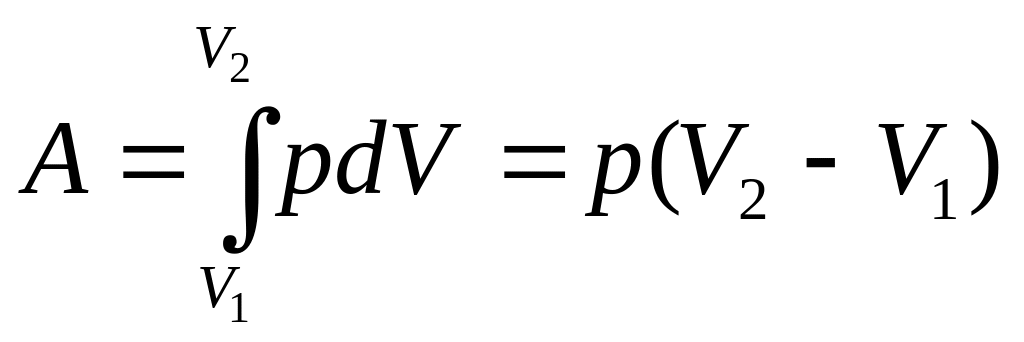
При изотермическом процессе
![]() из уравнения состояния
из уравнения состояния
![]() и
и
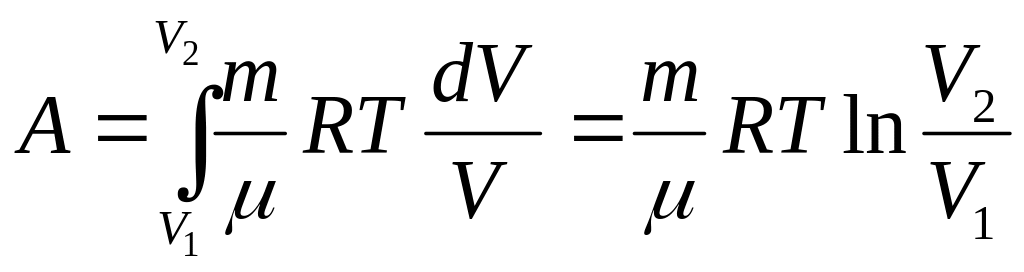 (9.5)
(9.5)
С учетом (9.4) первое начало записывают в виде:
![]() (9.6)
(9.6)
