
- •Физические основы классической механики
- •I. Механика. Общие понятия
- •2. Кинематика точки
- •3. Скорость
- •4. Ускорение
- •5. Примеры
- •I. Основные понятия
- •2. Законы механики
- •3. Инерциальные системы отсчёта (и.С.О.)
- •4. Принципы относительности Галилея
- •5. Закон сохранения импульса
- •6. Реактивное движение
- •7. Центр инерции
- •I. Работа
- •2. Энергия
- •3. Кинетическая и потенциальная энергии
- •4. Закон сохранения механической энергии
- •5. Удар абсолютно упругих и неупругих тел
- •I. Кинематика вращательного движения
- •2. Кинетическая энергия вращательного движения. Момент инерции.
- •3. Основное уравнение динамики вращательного движения
- •4. Момент импульса. Закон сохранения момента импульса
- •I. Принцип относительности
- •2. Постулаты Эйнштейна
- •3. Преобразования Лоренца
- •4. Замедление времени
- •5. Сокращение длин
- •6. Сложение скоростей в теории относительности.
- •7. Изменение массы со скоростью
- •8. Движение релятивистской частицы
- •9. Связь между массой и энергией
- •10. Кинетическая энергия. Энергия и импульс
- •Колебания и волны
- •1. Общие сведения о колебаниях
- •2. Механические колебания
- •3. Энергия гармонических колебаний
- •1. Предмет молекулярной физики
- •2. Термодинамические параметры.
- •3. Идеальный газ
- •4. Основное уравнение мкт газов для давления.
- •5. Газовые законы как следствие молекулярно-кинетической теории.
- •1. Скорости теплового движения молекул
- •2. Распределение молекул по скоростям (Закон Максвелла)
- •3. Закон распределения Больцмана
- •4. Число столкновений и средняя длина свободного пробега молекул
- •1. Внутренняя энергия идеального газа
- •2. Первое начало термодинамики
- •3. Работа при расширении газа
- •4. Теплоемкость идеальных газов
- •5. Адиабатический процесс
- •1. Характеристика тепловых процессов.
- •2. Принцип действия тепловой машины
- •3. Второе начало термодинамики
- •1. Энтропия
- •1. Отклонение свойств газов от идеальных.
- •2. Уравнение состояния реального газа (уравнение Ван-дер-Ваальса)
- •1. Критическое состояние вещества
- •1. Внутренняя энергия реального газа
- •1. Жидкости.
- •2. Поверхностное натяжение.
- •3. Явление смачивания.
- •4. Формула Лапласа.
- •5. Капиллярность.
1. Скорости теплового движения молекул
Средняя скорость молекул в газе обычно
характеризуется среднеквадратичной
или тепловой скоростью
![]() .
Из (7.2) следует, что
.
Из (7.2) следует, что
![]() (8.1)
(8.1)
так как
![]() ,а
m - масса молекулы. Из (8.1)
можно подсчитать, что для водорода
при
,а
m - масса молекулы. Из (8.1)
можно подсчитать, что для водорода
при
![]() для кислорода
для кислорода
![]() и т.д.
и т.д.
Однако молекулы даже одного сорта газа при одних и тех те условиях имеют неодинаковые скорости. Это связано с тем, что для молекул, совершавших беспорядочное движение, все направления равноправными абсолютные значения скоростей, поэтому не могут быть одинаковыми. Даже если они случайно в какой-то момент времени скорости и оказались бы одинаковыми, то в дальнейшем такое состояние быстро бы нарушилось из-за столкновений между собой.
Благодаря беспорядочному движению и
взаимным столкновениям молекулы
газа распределяются по скоростям так,
что среди них имеются как очень быстрые,
так и очень медленные молекулы (![]() ).
Такое распределение, как показывает
опыт, является не случайным, а вполне
определенным. На его характер не влияют
ни столкновения молекул, ни внешние
воздействия.
).
Такое распределение, как показывает
опыт, является не случайным, а вполне
определенным. На его характер не влияют
ни столкновения молекул, ни внешние
воздействия.
Таким образом, скорости молекул неодинаковы и подчиняются определённым закономерностям имеющим статистический характер.
2. Распределение молекул по скоростям (Закон Максвелла)
Поскольку значение скоростей молекул
может быть бесконечно большое, а само
число молекул ограниченно, то находят
не число молекул, обладающих той или
иной скоростью, а число молекул или их
часть, обладающих скоростями, лежащими
в некотором интервале
![]() вблизи заданной скорости
.
Например, число молекул, скорости которых
лежат в пределах от 500 до 510 м/с (
вблизи заданной скорости
.
Например, число молекул, скорости которых
лежат в пределах от 500 до 510 м/с (![]() ).
).
Относительное число молекул
![]() ,
скорости которых лежат в интервале
,
скорости которых лежат в интервале
![]() ,
зависит од скорости V и тем больше, чем
больше и
,
т.е.
,
зависит од скорости V и тем больше, чем
больше и
,
т.е.
![]() (8.2)
(8.2)
ф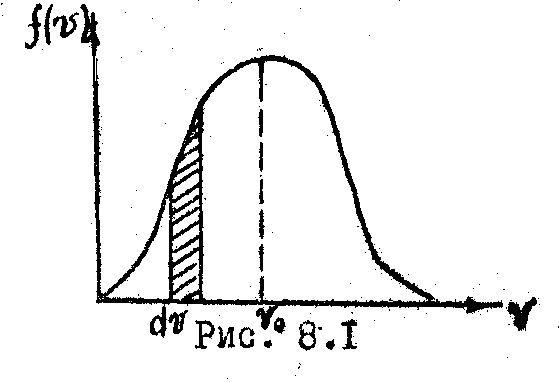 ункция
ункция
![]() называется функцией распределения. При
называется функцией распределения. При
![]()
![]() ,
т.е. равна доле молекул, скорости которых
заключены в единичном интервале
скоростей. Так, как
имеет смысл вероятности, то
- вероятность того, что молекула газа
имеет скорость, заключенную в единичном
интервале вблизи
.
Можно графически представить зависимость
,
т.е. равна доле молекул, скорости которых
заключены в единичном интервале
скоростей. Так, как
имеет смысл вероятности, то
- вероятность того, что молекула газа
имеет скорость, заключенную в единичном
интервале вблизи
.
Можно графически представить зависимость
![]() от скорости
.
Число молекул
от скорости
.
Число молекул
![]() ,
имеющих скорости
,
имеющих скорости
![]() ,
равны нулю.
,
равны нулю.
Поэтому искомая зависимость, как следует
из математики, должна иметь максимум
при
![]() и асимптотически приближаться к оси
абсцисс при
и асимптотически приближаться к оси
абсцисс при
![]() (рис. 8.1). Аналитический вид ее для
одинаковых молекул был рассчитан
Максвеллом и. носит название закона
распределения скоростей Максвелла:
(рис. 8.1). Аналитический вид ее для
одинаковых молекул был рассчитан
Максвеллом и. носит название закона
распределения скоростей Максвелла:
![]() (8.3)
(8.3)
М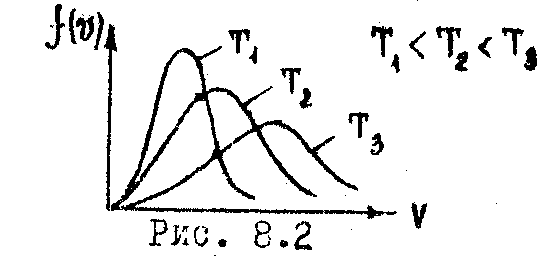 аксимум
этой функции при
означает, что наибольшая доля всех
молекул движется со скоростями, близкими
к
аксимум
этой функции при
означает, что наибольшая доля всех
молекул движется со скоростями, близкими
к
![]() .
Эту скорость поэтому называют наивероятной
скоростью. Пользуясь кривой распределения,
модно найти долю молекул
,
имеющих скорость в заданной интервале
.Она
равна площади заштрихованной полосы.
Вся же площадь под кривой дает полное
число молекул я данном объёме. С повышением
температуры скорости молекул возрастают,
и кривая смещается в сторону больших
скоростей (Рис. 8.2). Пользуясь (8.3) можно
вычислить среднюю арифметическую
.
Эту скорость поэтому называют наивероятной
скоростью. Пользуясь кривой распределения,
модно найти долю молекул
,
имеющих скорость в заданной интервале
.Она
равна площади заштрихованной полосы.
Вся же площадь под кривой дает полное
число молекул я данном объёме. С повышением
температуры скорости молекул возрастают,
и кривая смещается в сторону больших
скоростей (Рис. 8.2). Пользуясь (8.3) можно
вычислить среднюю арифметическую
![]() и наивароятную скорость
и наивароятную скорость
![]() .
Вычисления дают:
.
Вычисления дают:
![]() (8.4);
(8.4); ![]() (8.5)
(8.5)
Для решения практических задач удобно
закон Максвелла (8.3) записывать через
относительную скорость
![]() .
Из (8.5) и (8.3) можно получить:
.
Из (8.5) и (8.3) можно получить:
![]() (8.6)
(8.6)
В таком виде обычно пользуются законом Максвелла для решения задач, связанных с распределением молекул по скоростям. Экспериментальная проверка формулы распределения Максвелла впервые была проведена О. Штерном в 1920 г.
