
- •Часть IV
- •1. Введение
- •1.1. Строение азота
- •1.2. Химические связи азота
- •2. Амины
- •2.1. Номенклатура аминов
- •2.2. Изомерия аминов
- •2.3. Свойства аминов
- •2.3.1. Физические свойства аминов
- •2.3.2. Химические свойства аминов
- •III. Взаимодействие с азотистой кислотой
- •2.4. Анилин
- •2.5. Получение аминов
- •2.6. Контрольные вопросы
- •5. Какие реакции характерны для анилина?
- •6. В приведенной схеме превращений соединением, относящимся к классу аминов, является . . .
- •3. Гетероциклические соединения
- •3.1. Пиридин
- •3.2. Пиррол
- •3.3. Пиримидин и пурин
- •3.3.1. Пиримидиновые основания
- •4. Аминокислоты
- •Vrml-модель
- •4.1. Номенклатура аминокислот
- •Некоторые важнейшие -аминокислоты общей формулы
- •4.2. Изомерия аминокислот
- •4.3. Свойства аминокислот
- •5. Заключение
- •Биогеохимический цикл азота Биогеохимический цикл азота
2.3.1. Физические свойства аминов
Связь N–H является полярной, поэтому первичные и вторичные амины образуют межмолекулярные водородные связи (несколько более слабые, чем Н-связи с участием группы О–Н).

Это объясняет относительно высокую температуру кипения аминов по сравнению с неполярными соединениями со сходной молекулярной массой. Например:
![]()
При обычной температуре только низшие жирные амины CH3NH2, (CH3)2NH, (CH3)3N – газы (с запахом аммиака), средние амины – жидкости с резким запахом гниющей рыбы, высшие – твердые вещества без запаха.
Амины способны к образованию водородных связей с водой:

Поэтому низшие амины хорошо растворимы в воде. С увеличением числа и размеров углеводородных радикалов растворимость аминов в воде уменьшается, т.к. увеличиваются пространственные препятствия образованию водородных связей. Ароматические амины – бесцветные жидкости и твердые вещества с неприятным запахом, в воде практически не растворяются.
2.3.2. Химические свойства аминов
Амины, являясь производными аммиака, имеют сходное с ним строение и проявляют подобные ему свойства.
Модели молекул
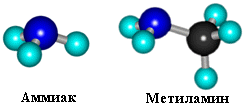
Как в аммиаке, так и в аминах атом азота имеет неподеленную пару электронов:
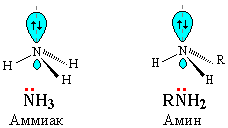
Поэтому амины подобно аммиаку проявляют свойства оснований.
I. Свойства аминов как оснований (акцепторов протонов) 1. Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
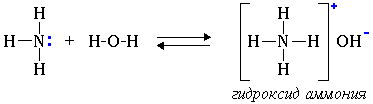

Связь протона с амином, как и с аммиаком, образуется по донорно-акцепторному механизму за счет неподеленной электронной пары атома азота. Алифатические амины – более сильные основания, чем аммиак, т.к. алкильные радикалы увеличивают электронную плотность на атоме азота за счет +I-эффекта. По этой причине электронная пара атома азота удерживается менее прочно и легче взаимодействует с протоном.
2. Взаимодействуя с кислотами, амины образуют соли:
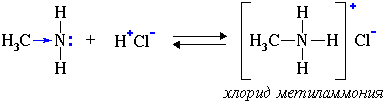
Соли аминов – твердые вещества, хорошо растворимые в воде. При нагревании щелочи вытесняют из них амины:
![]()
Ароматические амины являются более слабыми основаниями, чем аммиак, поскольку неподеленная электронная пара атома азота смещается в сторону бензольного кольца, вступая в сопряжение с его -электронами.
 или
или
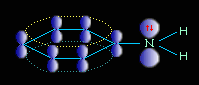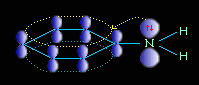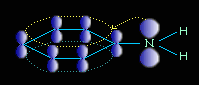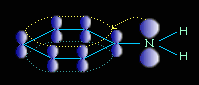
Уменьшение электронной плотности на атоме азота приводит к снижению способности отщеплять протоны от слабых кислот. Поэтому анилин взаимодействует лишь с сильными кислотами (HCl, H2SO4), а его водный раствор не окрашивает лакмус в синий цвет.
Таким образом, основные свойства изменяются в ряду:
C6H5NH2 < NH3 < RNH2 < R2NH < R3N (в газовой фазе)
II. Окисление аминов Амины, особенно ароматические, легко окисляются на воздухе. В отличие от аммиака, они способны воспламеняться от открытого пламени.
4СH3NH2 + 9O2 4CO2 + 10H2O + 2N2
III. Взаимодействие с азотистой кислотой
Азотистая кислота HNO2 – неустойчивое соединение. Поэтому она используется только в момент выделения. Образуется HNO2, как все слабые кислоты, действием на ее соль (нитрит) сильной кислотой:
KNO2 + HCl НNO2 + KCl
или NO2 + H НNO2
Строение продуктов реакции с азотистой кислотой зависит от характера амина. Поэтому данная реакция используется для различения первичных, вторичных и третичных аминов.
Первичные алифатические амины c HNO2 образуют спирты:
R-NH2 + HNO2 R-OH + N2 + H2O
Первичные ароматические амины при повышенной температуре реагируют аналогично, образуя фенолы. При низкой температуре (около 0 С) реакция идет иначе (см. ниже, раздел 2.4).
Вторичные амины (алифатические и ароматические) под действием HNO2 превращаются в нитрозосоединения (вещества с характерным запахом):
R2NH + H-O-N=O R2N-N=O + H2O алкилнитрозамин
Реакция с третичными аминами приводит к образованию неустойчивых солей и не имеет практического значения.
