
- •Часть IV
- •1. Введение
- •1.1. Строение азота
- •1.2. Химические связи азота
- •2. Амины
- •2.1. Номенклатура аминов
- •2.2. Изомерия аминов
- •2.3. Свойства аминов
- •2.3.1. Физические свойства аминов
- •2.3.2. Химические свойства аминов
- •III. Взаимодействие с азотистой кислотой
- •2.4. Анилин
- •2.5. Получение аминов
- •2.6. Контрольные вопросы
- •5. Какие реакции характерны для анилина?
- •6. В приведенной схеме превращений соединением, относящимся к классу аминов, является . . .
- •3. Гетероциклические соединения
- •3.1. Пиридин
- •3.2. Пиррол
- •3.3. Пиримидин и пурин
- •3.3.1. Пиримидиновые основания
- •4. Аминокислоты
- •Vrml-модель
- •4.1. Номенклатура аминокислот
- •Некоторые важнейшие -аминокислоты общей формулы
- •4.2. Изомерия аминокислот
- •4.3. Свойства аминокислот
- •5. Заключение
- •Биогеохимический цикл азота Биогеохимический цикл азота
Часть IV
|
Азотсодержащие органические соединения |
![]()
1. Введение 1.1.Азот 1.2.Связи азота |
2. Амины 2.1.Номенклатура 2.2.Изомерия 2.3.Свойства аминов 2.3.1.Физические свойства 2.3.2.Химические свойства 2.4.Анилин 2.5.Получение аминов 2.6.Контрольные вопросы |
3. Гетероциклические соединения 3.1.Пиридин 3.2.Пиррол 3.3.Пиримидин, пурин 3.3.1.Пиримидиновые основания 3.3.2.Пуриновые основания 3.4.Контрольные вопросы |
4. Аминокислоты 4.1.Номенклатура 4.2.Изомерия 4.3.Свойства 4.4.Получение 4.5.Контрольные вопросы |
5. Заключение
|
1. Введение
Известно множество природных и синтетических органических соединений, содержащих в своем составе атомы азота. Некоторые из таких соединений уже встречались нам в предыдущих частях учебника:
нитросоединения R-NO2;
нитраты R-O-NO2 ;
амиды карбоновых кислот R-CONH2 ;
нитрилы R-CN .
В этой части мы рассмотрим другие важные азотсодержащие соединения: амины (R-NH2), некоторые азотистые гетероциклы (гетероциклические амины) и аминокислоты (NH2-R-COOH).
Чтобы лучше понять строение и свойства этих соединений, необходимо вспомнить электронное строение атома азота и дать характеристики его химическим связям с другими атомами (водородом, углеродом, кислородом).
Для иллюстрации строения молекул используются их модели, в которых принято следующее изображение атомов:
1.1. Строение азота
Азот – элемент VА группы 2-го периода Периодической системы элементов (21354 байт); порядковый номер 7; атомная масса 14,01; электроотрицательность 3,0. Электронная конфигурация в основном состоянии 1s22s22p3:
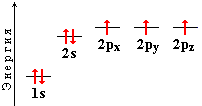
Подобно углероду, азот в различных соединениях может находиться в состояниях sp3, sp2 или sp-гибридизации.

1.2. Химические связи азота
Строение и, следовательно, свойства соединений азота определяются характером его химических связей и типом гибридизации, влияющей на форму молекулы.
Тип гибридизации азота |
Электронная конфигурация |
Число гибридных орбиталей |
Валентный угол |
sp3 |
1s2 (2sp3)5 |
4 |
107 |
sp2 |
1s2 (2sp2)4 2p1 |
3 |
120 |
sp |
1s2 (2sp)3 2p2 |
2 |
180 |
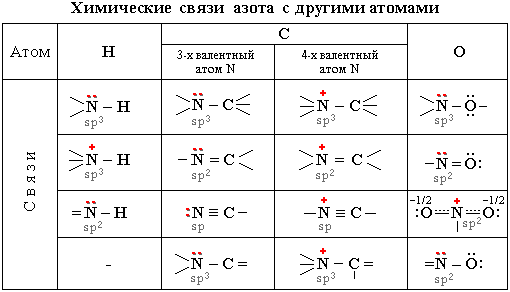
За счет трех одноэлектронных АО азот способен к образованию трех ковалентных связей с другими атомами по обменному механизму. В этом случае азот проявляет валентность 3 и имеет неподеленную электронную пару. Такой атом азота может выступать донором пары электронов, образуя четвертую связь по донорно-акцепторному механизму. При этом азот пробретает максимальную валентность 4 (напомним, что максимальная валентность атома определяется числом его внешних атомных орбиталей; у азота их четыре - одна 2s и три 2p). Четырехвалентный азот несет на себе положительный заряд и может участвовать в образовании ионной связи (подобно иону аммония [NH4]+).
 <>
<>
Электроотрицательности азота, водорода, углерода и кислорода равны, соответственно, 3.0, 2.1, 2.5 и 3.5. Поэтому связи азота с Н, С или О являются ковалентными полярными. В связях трехвалентного азота с углеродом или водородом электронная плотность смещена к более электроотрицательному атому азота, создавая на нем частичный отрицательный заряд, а на углероде или водороде - частичный положительный. В связях азота с кислородом, напротив, электронная плотность смещена от атома азота к атому кислорода, электроотрицательность которого выше. Связи с четырехвалентным азотом, несущим положительный заряд, отличаются более высокой полярностью.
Распределение электронной плотности на атомах в молекуле определяет ее реакционную способность.

