
- •Часть III
- •1. Введение
- •1. Введение
- •1.1. Строение кислорода
- •1.2. Химические связи кислорода
- •2. Гидроксисоединения
- •2.1. Спирты
- •2.1.1. Классификация спиртов
- •2.1.2. Номенклатура спиртов
- •2.1.3. Изомерия спиртов
- •2.2. Фенолы
- •2.3. Строение гидроксильной группы
- •Мезомерный эффект он-группы в феноле
- •2.4. Водородные связи и физические свойства
- •2.5. Химические свойства гидроксисоединений
- •2.5.1. Реакции по связи о–н
- •2.5.1.1. Кислотные свойства гидроксисоединений
- •2.5.1.2. Образование сложных эфиров
- •2.5.1.3. Окисление
- •2.5.2. Реакции по связи с–о
- •2.5.2.1. Реакции замещения он-группы
- •2.5.2.2. Реакции дегидратации спиртов
- •2.5.3. Простые эфиры
- •2.5.4. Реакции фенола по бензольному кольцу
- •2.6. Получение спиртов и фенолов
- •2.7. Применение гидроксисоединений
- •2.8. Контрольные вопросы
- •2. Сколько первичных, вторичных и третичных спиртов приведено ниже?
- •3. Альдегиды и кетоны
- •Для перехода к виртуальной (vrml) модели щелкните на нужной картинке.
- •3.1. Номенклатура альдегидов и кетонов
- •3.2. Изомерия альдегидов и кетонов
- •3.4. Реакции альдегидов и кетонов
- •3.4.1. Реакции присоединения по карбонильной группе
- •3.4.2. Реакции полимеризации карбонильных соединений
- •3.4.3. Реакции конденсации карбонильных соединений
- •3.4.4. Реакции восстановления альдегидов и кетонов
- •3.4.5. Реакции окисления альдегидов и кетонов
- •3.5. Получение альдегидов и кетонов
- •3.6. Применение альдегидов и кетонов
- •4.1. Классификация карбоновых кислот
- •4.2. Номенклатура карбоновых кислот
- •Некоторые предельные одноосновные кислоты
- •4.3. Изомерия карбоновых кислот
- •4.4. Строение карбоксильной группы
- •4.5. Функциональные производные карбоновых кислот
- •4.6. Сложные эфиры
- •4.7. Жиры
- •4.8. Контрольные вопросы
- •2. Какая из приведенных структур соответствует молекуле жира?
- •5. Углеводы
- •5.1. Моносахариды
- •Vrml-модели (30589 и 30602 байт)
- •Пространственные формы (конформации) шестичленного цикла
- •5.2. Дисахариды
- •6.2. Полисахариды
- •6.2.1. Крахмал
- •6.2.2. Целлюлоза
- •5.3. Контрольные вопросы
- •1. Какая формула соответствует фруктозе?
- •6. Заключение
4.1. Классификация карбоновых кислот
Карбоновые кислоты классифицируют по двум структурным признакам.
По числу карбоксильных групп кислоты подразделяются на:
одноосновные (монокарбоновые) Например:

многоосновные (дикарбоновые, трикарбоновые и т.д.).

По характеру углеводородного радикала различают кислоты:
предельные (например, CH3CH2CH2COOH);
непредельные (CH2=CHCH2COOH);
и ароматические (RC6H4COOH).
4.2. Номенклатура карбоновых кислот
Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота.
Часто используются также тривиальные названия.
Некоторые предельные одноосновные кислоты
Формула |
Название |
|
систематическое |
тривиальное |
|
HCOOH |
метановая |
муравьиная |
CH3COOH |
этановая |
уксусная |
C2H5COOH |
пропановая |
пропионовая |
C3H7COOH |
бутановая |
масляная |
C4H9COOH |
пентановая |
валерьяновая |
C5H11COOH |
гексановая |
капроновая |
C15H31COOH |
пентадекановая |
пальмитиновая |
C17H35COOH |
гептадекановая |
стеариновая |
4.3. Изомерия карбоновых кислот
Cтруктурная изомерия - изомерия скелета в углеводородном радикале (начиная с C4).

- межклассовая изомерия, начиная с C2. Например, формуле C2H4O2 соответствуют 3 изомера, относящиеся к различным классам органических соединений.

Пространственная изомерия Возможна цис-транс изомерия в случае непредельных карбоновых кислот. Например:

4.4. Строение карбоксильной группы
Карбоксильная группа сочетает в себе две функциональные группы - карбонил и гидроксил, взаимно влияющие друг на друга:

Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н. В водном растворе карбоновые кислоты диссоциируют на ионы:
![]()
Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.


С увеличением молекулярной массы растворимость кислот в воде уменьшается.
4.5. Функциональные производные карбоновых кислот
Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.
1. Образование солей
а) при взаимодействии с металлами:
2RCOOH + Mg (RCOO)2Mg + H2
б) в реакциях с гидроксидами металлов:
2RCOOH + NaOH RCOONa + H2O
2. Образование сложных эфиров R'–COOR":

Реакция образования сложного эфира из кислоты и спирта называется реакцией этерификации (от лат. ether - эфир).
3. Образование амидов:

Вместо карбоновых кислот чаще используют их галогенангидриды:
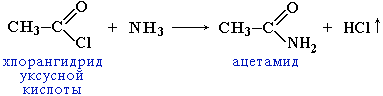
Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):
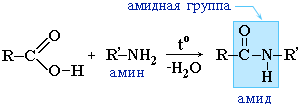
Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из -аминокислот с участием амидных групп - пептидных связей (часть V, раздел 4.3, часть VI, раздел 6.3).
