
- •Часть II
- •1. Введение
- •1.1. Многообразие углеводородов
- •1.2. Классификация углеводородов
- •2.1. Гомологический ряд алканов
- •2.2. Строение алканов
- •2.3. Изомерия алканов
- •2.3.1. Структурная изомерия алканов
- •2.3.2. Поворотная изомерия алканов
- •2.3.3. Зеркальная (оптическая) изомерия
- •2.4. Номенклатура
- •2.4.1. Радикалы в ряду алканов
- •2.4.2. Правила построения названий алканов по систематической международной номенклатуре июпак
- •2.4.3. Назовем соединение по номенклатуре июпак
- •2.5. Химические свойства алканов
- •2.5.1. Крекинг алканов
- •2.5.2. Изомеризация алканов
- •2.5.3. Дегидрирование алканов
- •2.5.4. Реакции окисления алканов
- •2.5.5. Реакции замещения
- •2.6. Галогеналканы
- •2.7. Получение алканов
- •2.8. Применение алканов
- •3.1. Изомерия циклоалканов
- •3.2. Свойства циклоалканов
- •3.3. Получение циклоалканов
- •I. Br2, h; II. Br2 (вода); III. HCl; IV. KMnO4 (водн. Р-р).
- •6. Какие соединения образуются при действии металлического натрия на следующие вещества:
- •4. Алкены
- •Vrml-модель (2 камеры, 109300 байт).
- •Vrml-модель (37448 байт)
- •4.2. Номенклатура алкенов
- •2 Атома с этан этен; 3 атома с пропан пропен и т.Д.
- •4.3. Изомерия алкенов
- •4.3.1. Структурная изомерия алкенов
- •4.3.2. Пространственная изомерия алкенов
- •Vrml-модель
- •4.4. Свойства алкенов
- •4.4.1 Реакции присоединения к алкенам
- •4.4.1.1. Гидрирование (присоединение водорода)
- •4.4.1.2. Галогенирование (присоединение галогенов)
- •4.4.1.3. Гидрогалогенирование (присоединение галогеноводородов)
- •4.4.1.5. Полимеризация алкенов
- •4.4.2. Реакции окисления алкенов
- •4.4.3. Изомеризация алкенов
- •4.5. Получение алкенов
- •4.6. Применение алкенов
- •4.7. Контрольные вопросы
- •1. Какие модели соответствуют молекулам алкенов?
- •Тройная связь в ацетилене
- •6.2. Номенклатура алкинов
- •6.3. Изомерия алкинов
- •6.4. Свойства алкинов
- •6.4.2. Образование солей
- •6.4.3. Окисление алкинов
- •6.5. Получение алкинов
- •7.1. Строение бензола
- •Cтроение бензола
- •7.2. Гомологи бензола. Номенклатура и изомерия
- •7.3. Свойства аренов
- •7.3.1. Реакции замещения в бензольном кольце
- •1. Галогенирование
- •2. Нитрование
- •7.3.2. Замещение в алкилбензолах
- •7.3.3. Реакции присоединения к аренам
- •7.3.4. Реакции окисления аренов
- •7.4. Получение ароматических углеводородов
- •7.5. Применение ароматических углеводородов
- •9. Заключение. Генетическая связь между углеводородами
- •4.5. Получение алкенов
2.4.2. Правила построения названий алканов по систематической международной номенклатуре июпак
Для простейших алканов (С1-С4) приняты тpивиальные названия: метан, этан, пpопан, бутан, изобутан.
Начиная с пятого гомолога, названия нормальных (неpазветвленных) алканов стpоят в соответствии с числом атомов углеpода, используя гpеческие числительные и суффикс -ан: пентан, гексан, гептан, октан, нонан, декан и т.д.
В основе названия разветвленного алкана лежит название входящего в его конструкцию нормального алкана с наиболее длинной углеродной цепью. При этом углеводоpод с pазветвленной цепью pассматpивают как пpодукт замещения атомов водоpода в ноpмальном алкане углеводоpодными pадикалами.
Например, алкан
![]()
рассматривается как замещенный пентан, в котором два атома водорода замещены на радикалы –СН3 (метил).
Порядок построения названия разветвленного алкана
Выбрать в молекуле главную углеродную цепь. Во-первых, она должна быть самой длинной. Во-вторых, если имеются две или более одинаковые по длине цепи, то из них выбирается наиболее разветвленная. Например, в молекуле есть 2 цепи с одинаковым числом (7) атомов С (выделены цветом):

В случае (а) цепь имеет 1 заместитель, а в (б) – 2. Поэтому следует выбрать вариант (б).
Пронумеровать атомы углерода в главной цепи так, чтобы атомы С, связанные с заместителями, получили возможно меньшие номера. Поэтому нумерацию начинают с ближайшего к ответвлению конца цепи. Например:
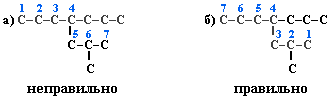
Назвать все радикалы (заместители), указав впереди цифры, обозначающие их местоположение в главной цепи. Если есть несколько одинаковых заместителей, то для каждого из них через запятую записывается цифра (местоположение), а их количество указывается приставками ди-, три-, тетра-, пента- и т.д. (например, 2,2-диметил или 2,3,3,5-тетраметил).
Названия всех заместителей расположить в алфавитном порядке (так установлено последними правилами ИЮПАК).
Назвать главную цепь углеродных атомов, т.е. соответствующий нормальный алкан.
Таким образом, в названии разветвленного алкана
корень+суффикс – название нормального алкана (греч. числительное+суффикс "ан"), приставки – цифры и названия углеводородных радикалов.
Пример построения названия:
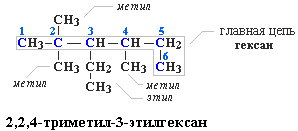
Другой пример последовательного построения названия по шагам приведен в разделе 2.4.3.
2.4.3. Назовем соединение по номенклатуре июпак
Рисунок –анимация не копируется без программы
2.5. Химические свойства алканов
Химические свойства любого соединения определяются его строением, т.е. природой входящих в его состав атомов и характером связей между ними.
Исходя из этого положения и справочных данных о связях С–С и С–Н, попробуем предсказать, какие реакции характерны для алканов.

Во-первых, предельная насыщенность алканов не допускает реакций присоединения, но не препятствует реакциям разложения, изомеризации и замещения (см. I часть, раздел 6.4 "Типы реакций").
Во-вторых, симметричность неполярных С–С и слабополярных С–Н ковалентных связей (см. значения дипольных моментов в табл. 2.5.1) предполагает их гомолитический (симметричный) разрыв на свободные радикалы (часть I, раздел 6.4.3).
Следовательно, для реакций алканов характерен радикальный механизм.
Поскольку гетеролитический разрыв связей С–С и С–Н в обычных условиях не происходит, то в ионные реакции алканы практически не вступают. Это проявляется в их устойчивости к действию полярных реагентов (кислот, щелочей, окислителей ионного типа: КMnO4, К2Сr2O7 и т.п.). Такая инертность алканов в ионных реакциях и послужила ранее основанием считать их неактивными веществами и назвать парафинами.
Итак, алканы проявляют свою реакционную способность в основном в радикальных реакциях.
Условия проведения таких реакций: повышенная температура (часто реакцию проводят в газовой фазе), действие света или радиоактивного излучения, присутствие соединений – источников свободных радикалов (инициаторов), неполярные растворители.
В зависимости от того, какая связь в молекуле разрывается в первую очередь, реакции алканов подразделяются на следующие типы.
С разрывом связей С–С происходят реакции разложения (крекинг алканов) и изомеризации углеродного скелета.
По связям С–Н возможны реакции замещения атома водорода или его отщепления (дегидрирование алканов).
Кроме того, атомы углерода в алканах находятся в наиболее восстановленной форме (степень окисления углерода, например, в метане равна –4, в этане –3 и т.д.) и в присутствии окислителей в определенных условиях будут происходить реакции окисления алканов с участием связей С–С и С–Н.
