- •Часть II
- •1. Введение
- •1.1. Многообразие углеводородов
- •1.2. Классификация углеводородов
- •2.1. Гомологический ряд алканов
- •2.2. Строение алканов
- •2.3. Изомерия алканов
- •2.3.1. Структурная изомерия алканов
- •2.3.2. Поворотная изомерия алканов
- •2.3.3. Зеркальная (оптическая) изомерия
- •2.4. Номенклатура
- •2.4.1. Радикалы в ряду алканов
- •2.4.2. Правила построения названий алканов по систематической международной номенклатуре июпак
- •2.4.3. Назовем соединение по номенклатуре июпак
- •2.5. Химические свойства алканов
- •2.5.1. Крекинг алканов
- •2.5.2. Изомеризация алканов
- •2.5.3. Дегидрирование алканов
- •2.5.4. Реакции окисления алканов
- •2.5.5. Реакции замещения
- •2.6. Галогеналканы
- •2.7. Получение алканов
- •2.8. Применение алканов
- •3.1. Изомерия циклоалканов
- •3.2. Свойства циклоалканов
- •3.3. Получение циклоалканов
- •I. Br2, h; II. Br2 (вода); III. HCl; IV. KMnO4 (водн. Р-р).
- •6. Какие соединения образуются при действии металлического натрия на следующие вещества:
- •4. Алкены
- •Vrml-модель (2 камеры, 109300 байт).
- •Vrml-модель (37448 байт)
- •4.2. Номенклатура алкенов
- •2 Атома с этан этен; 3 атома с пропан пропен и т.Д.
- •4.3. Изомерия алкенов
- •4.3.1. Структурная изомерия алкенов
- •4.3.2. Пространственная изомерия алкенов
- •Vrml-модель
- •4.4. Свойства алкенов
- •4.4.1 Реакции присоединения к алкенам
- •4.4.1.1. Гидрирование (присоединение водорода)
- •4.4.1.2. Галогенирование (присоединение галогенов)
- •4.4.1.3. Гидрогалогенирование (присоединение галогеноводородов)
- •4.4.1.5. Полимеризация алкенов
- •4.4.2. Реакции окисления алкенов
- •4.4.3. Изомеризация алкенов
- •4.5. Получение алкенов
- •4.6. Применение алкенов
- •4.7. Контрольные вопросы
- •1. Какие модели соответствуют молекулам алкенов?
- •Тройная связь в ацетилене
- •6.2. Номенклатура алкинов
- •6.3. Изомерия алкинов
- •6.4. Свойства алкинов
- •6.4.2. Образование солей
- •6.4.3. Окисление алкинов
- •6.5. Получение алкинов
- •7.1. Строение бензола
- •Cтроение бензола
- •7.2. Гомологи бензола. Номенклатура и изомерия
- •7.3. Свойства аренов
- •7.3.1. Реакции замещения в бензольном кольце
- •1. Галогенирование
- •2. Нитрование
- •7.3.2. Замещение в алкилбензолах
- •7.3.3. Реакции присоединения к аренам
- •7.3.4. Реакции окисления аренов
- •7.4. Получение ароматических углеводородов
- •7.5. Применение ароматических углеводородов
- •9. Заключение. Генетическая связь между углеводородами
- •4.5. Получение алкенов
2.1. Гомологический ряд алканов
Алканы, имея общую формулу СnH2n+2, представляют собой ряд родственных соединений с однотипной структурой, в котором каждый последующий член отличается от предыдущего на постоянную группу атомов (-CH2-). Такая последовательность соединений называется гомологическим рядом (от греч. homolog - сходный), отдельные члены этого ряда – гомологами, а группа атомов, на которую различаются соседние гомологи, – гомологической разностью.
Гомологический ряд алканов легко составить, прибавляя каждый раз к предыдущей цепочке новый атом углерода и дополняя его оставшиеся валентности до 4-х атомами водорода. Другой вариант – добавление в цепь группы -СН2- (аним. 2.1.1, 43561 байт):
CH4 или Н-СН2-Н – первый член гомологического ряда – метан (содержит 1 атом C);
CH3-CH3 или Н-СН2-СН2-Н – 2-й гомолог – этан (2 атома С);
CH3-CH2-CH3 или Н-СН2-СН2-СН2 -Н – 3-й гомолог – пропан (3 атома С);
CH3-CH2-CH2-CH3 или Н-СН2-СН2-СН2-СН2-Н – бутан (4 атома С).
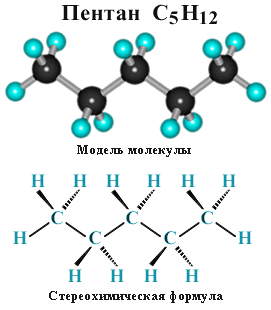
Суффикс -ан является характерным для названия всех алканов. Начиная с пятого гомолога, название алкана образуется из греческого числительного, указывающего число атомов углерода в молекуле, и суффикса -ан: пентан С5Н12, гексан С6Н14, гептан С7Н16, октан С8Н18, нонан С9Н20, декан С10Н22 и т.д.
Гомологи отличаются молекулярной массой, и следовательно, физическими характеристиками (рис.2.1.1). С увеличением числа углеродных атомов в молекуле алкана (с ростом молекулярной массы) в гомологическом ряду наблюдается закономерное изменение физических свойств гомологов (переход количества в качество): повышаются температуры кипения и плавления, увеличивается плотность. Алканы от СН4 до С4Н10– газы, от С5Н12 до С17Н36 – жидкости, далее – твердые вещества. Имея одинаковый качественный состав и однотипные химические связи, гомологи обладают сходными химическими свойствами. Поэтому, зная химические свойства одного из членов гомологического ряда, можно предсказать химическое поведение и других членов этого ряда.
Для получения гомологов используются общие методы синтеза.
2.2. Строение алканов
Химическое строение (порядок соединения атомов в молекулах) простейших алканов – метана, этана и пропана – показывают их структурные формулы, приведенные в разделе 2. Из этих формул видно, что в алканах имеются два типа химических связей:
С–С и С–Н.
Связь С–С является ковалентной неполярной. Связь С–Н - ковалентная слабополярная, т.к. углерод и водород близки по электроотрицательности (2.5 - для углерода и 2.1 - для водорода). Образование ковалентных связей в алканах за счет общих электронных пар атомов углерода и водорода можно показать с помощью электронных формул:
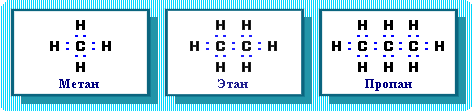
Электронные и структурные формулы отражают химическое строение, но не дают представления о пространственном строении молекул, которое существенно влияет на свойства вещества.
Пространственное строение, т.е. взаимное расположение атомов молекулы в пространстве, зависит от направленности атомных орбиталей (АО) этих атомов. В углеводородах главную роль играет пространственная ориентация атомных орбиталей углерода, поскольку сферическая 1s-АО атома водорода лишена определенной направленности.
Пространственное расположение АО углерода в свою очередь зависит от типа его гибридизации (часть I, раздел 4.3). Насыщенный атом углерода в алканах связан с четырьмя другими атомами. Следовательно, его состояние соответствует sp3-гибридизации (часть I, раздел 4.3.1). В этом случае каждая из четырех sp3-гибридных АО углерода участвует в осевом (-) перекрывании с s-АО водорода или с sp3-АО другого атома углерода, образуя -связи С-Н или С-С.
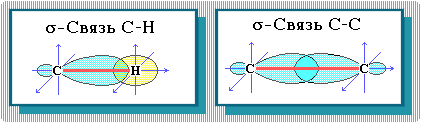
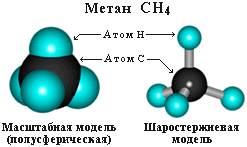
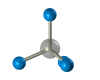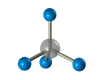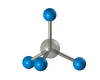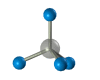
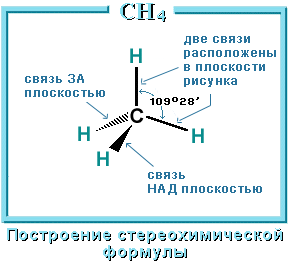
Четыре -связи углерода направлены в пространстве под тетраэдрическим углом 109о28'. Поэтому молекула простейшего представителя алканов – метана СН4 – имеет форму тетраэдра, в центре которого находится атом углерода, а в вершинах – атомы водорода:
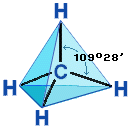
Валентный угол Н-С-Н равен 109о28’. Пространственное строение метана можно показать с помощью объемных (масштабных) и шаростержневых моделей.
См. также виртуальную (VRML) модель молекулы метана (2 камеры, 7199 байт).
Для записи удобно использовать пространственную (стереохимическую) формулу.
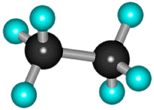
В молекуле следующего гомолога – этана С2Н6 – два тетраэдрических sp3- атома углерода образуют более сложную пространственную конструкцию:
Для молекул алканов, содержащих свыше 2-х атомов углерода, характерны изогнутые формы. Это можно показать на примере н-бутана (VRML-модель, 10574 байт) или н-пентана: