
- •Часть II
- •1. Введение
- •1.1. Многообразие углеводородов
- •1.2. Классификация углеводородов
- •2.1. Гомологический ряд алканов
- •2.2. Строение алканов
- •2.3. Изомерия алканов
- •2.3.1. Структурная изомерия алканов
- •2.3.2. Поворотная изомерия алканов
- •2.3.3. Зеркальная (оптическая) изомерия
- •2.4. Номенклатура
- •2.4.1. Радикалы в ряду алканов
- •2.4.2. Правила построения названий алканов по систематической международной номенклатуре июпак
- •2.4.3. Назовем соединение по номенклатуре июпак
- •2.5. Химические свойства алканов
- •2.5.1. Крекинг алканов
- •2.5.2. Изомеризация алканов
- •2.5.3. Дегидрирование алканов
- •2.5.4. Реакции окисления алканов
- •2.5.5. Реакции замещения
- •2.6. Галогеналканы
- •2.7. Получение алканов
- •2.8. Применение алканов
- •3.1. Изомерия циклоалканов
- •3.2. Свойства циклоалканов
- •3.3. Получение циклоалканов
- •I. Br2, h; II. Br2 (вода); III. HCl; IV. KMnO4 (водн. Р-р).
- •6. Какие соединения образуются при действии металлического натрия на следующие вещества:
- •4. Алкены
- •Vrml-модель (2 камеры, 109300 байт).
- •Vrml-модель (37448 байт)
- •4.2. Номенклатура алкенов
- •2 Атома с этан этен; 3 атома с пропан пропен и т.Д.
- •4.3. Изомерия алкенов
- •4.3.1. Структурная изомерия алкенов
- •4.3.2. Пространственная изомерия алкенов
- •Vrml-модель
- •4.4. Свойства алкенов
- •4.4.1 Реакции присоединения к алкенам
- •4.4.1.1. Гидрирование (присоединение водорода)
- •4.4.1.2. Галогенирование (присоединение галогенов)
- •4.4.1.3. Гидрогалогенирование (присоединение галогеноводородов)
- •4.4.1.5. Полимеризация алкенов
- •4.4.2. Реакции окисления алкенов
- •4.4.3. Изомеризация алкенов
- •4.5. Получение алкенов
- •4.6. Применение алкенов
- •4.7. Контрольные вопросы
- •1. Какие модели соответствуют молекулам алкенов?
- •Тройная связь в ацетилене
- •6.2. Номенклатура алкинов
- •6.3. Изомерия алкинов
- •6.4. Свойства алкинов
- •6.4.2. Образование солей
- •6.4.3. Окисление алкинов
- •6.5. Получение алкинов
- •7.1. Строение бензола
- •Cтроение бензола
- •7.2. Гомологи бензола. Номенклатура и изомерия
- •7.3. Свойства аренов
- •7.3.1. Реакции замещения в бензольном кольце
- •1. Галогенирование
- •2. Нитрование
- •7.3.2. Замещение в алкилбензолах
- •7.3.3. Реакции присоединения к аренам
- •7.3.4. Реакции окисления аренов
- •7.4. Получение ароматических углеводородов
- •7.5. Применение ароматических углеводородов
- •9. Заключение. Генетическая связь между углеводородами
- •4.5. Получение алкенов
4.4.1.5. Полимеризация алкенов
1. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
![]()
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям:
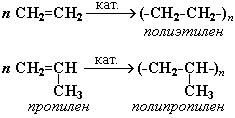
Подробнее процесс полимеризации и понятие о полимерах, имеющих исключительно важное практическое значение, рассматриваются в части VI "Высокомолекулярные соединения".
2. Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н+) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион:
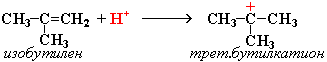
Этот карбокатион присоединяется к следующей молекуле алкена с образованием "димерного карбокатиона":

"Димерный карбокатион" стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов (2,4,4-триметипентена-2 и 2,4,4-триметилпентена-1):
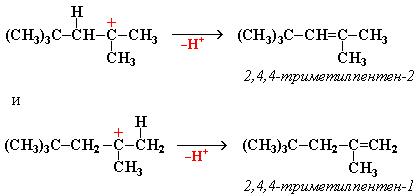
Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения "изооктана" (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина ("изооктан" – стандарт моторного топлива с октановым числом 100).
Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону.
4.4.2. Реакции окисления алкенов
Строение продуктов окисления алкенов зависит от условий реакции и природы окислителя.
1. Мягкое окисление алкенов водным раствором перманганата калия приводит к образованию двухатомных спиртов (реакция Вагнера):
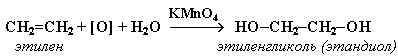
Полное уравнение реакции:
![]()
(см. схему электронного баланса этой реакции).
В ходе этой реакции происходит обесцвечивание фиолетовой окраски водного раствора KMnO4. Поэтому она используется как качественная реакция на алкены.
2. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
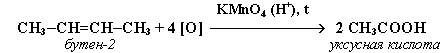
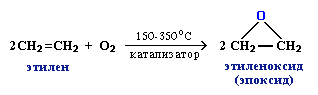
3. Промышленное значение имеет частичное окисление алкенов с образованием циклических оксидов, которые широко используются в органическом синтезе:
4. Полное окисление (горение):
![]()
Газообразные гомологи алкенов образуют с воздухом взрывчатые смеси.
Схема электронного баланса реакции окисления этилена раствором KMnO4
Полное уравнение реакции:
![]()
Электронный баланс:
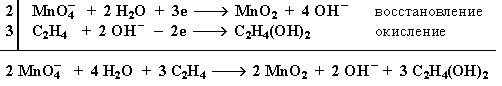
4.4.3. Изомеризация алкенов
Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
Изомеризация алкенов приводит или к перемещению –связи:
![]()
или к перестройке углеродного скелета:
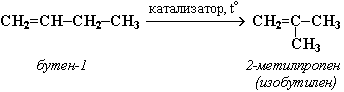
4.5. Получение алкенов
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:
![]()
Например:
![]()
II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи.
Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи
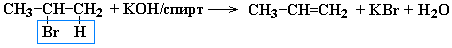
Дегидратация спиртов при температуре менее 150C в присутствии водоотнимающих реагентов
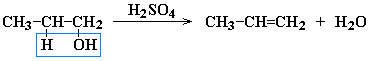
Реакции элиминирования идут в соответствии с правилом Зайцева: Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов. Такие алкены обладают более низкой энергией.
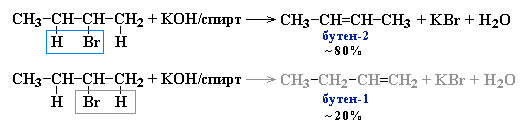
Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов :
![]()
Дегидрирование алканов при 500С:
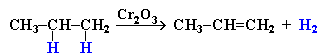
З АЙЦЕВ
Александр Михайлович (2.VII.1841 - 1.IX.1910)
АЙЦЕВ
Александр Михайлович (2.VII.1841 - 1.IX.1910)
Русский химик-органик, чл.-кор. Петербургской Академии Наук (с 1885 г.). Ученик А.М. Бутлерова. Родился в Казани. Окончил Казанский университет (1862). C 1865 г. работал в Казанском университете, с 1871 г. - профессор. Президент Русского физико-химического общества (1905, 1908, 1911 гг.)
Научные исследования А.М.Зайцева в основном направлены на развитие и усовершенствование органического синтеза и теории химического строения Бутлерова.
Разработал цинкорганические методы синтеза различных классов спиртов ("зайцевские спирты"), подтвердив предсказания теории Бутлерова о существовании таких спиртов и заложив основы одного из унивесальных направлений органического синтеза вообще.
Установил правило, согласно которому отщепление галогеноводородов от алкилгалогенидов или воды от спиртов происходит таким образом, что вместе с галогеном или гидроксилом уходит водород от наименее гидрогенизированного соседнего атома углерода (правило Зайцева).
Выполнил вместе с учениками многие работы по получению и изучению многоатомных спиртов, органических оксидов, непредельных кислот и гидроксикислот.
Создал крупную школу химиков, среди которых А.Е.Арбузов, Е.Е.Вагнер, А.Н.Реформатский, С.Н.Реформатский и др.
