
- •Часть I
- •1. Введение
- •1.1. Углерод
- •1.2. Органические соединения
- •1.3.Значение органической химии
- •Иллюстрация
- •1.4. Контрольные вопросы
- •2. Основы теории строения
- •2.1. Основные положения теории химического строения а.М.Бутлерова
- •2.1.1. Формулы строения
- •2.1.2. Понятие о изомерии
- •2.1.2.1. Структурные изомеры
- •2.1.2.2. Стереоизомеры
- •2.2. Электронные представления в органической химии
- •2.2.1. Свойства электрона
- •2.2.2. Атомные орбитали
- •2.2.3. Форма и энергия атомных орбиталей
- •2.2.4. Заполнение атомных орбиталей электронами
- •2.3. Контрольные вопросы
- •1. Какое из положений теории а.М. Бутлерова объясняет различие в реакциях соединений одинакового состава:
- •2. Изомерами называются . . .
- •3.1. Электроотрицательность элементов
- •3.2. Основные типы химических связей
- •3.2.1. Ионная связь
- •3.2.2. Ковалентная связь
- •3.2.2.1. Свойства ковалентной связи
- •3.2.2.2. Характеристики ковалентной связи
- •3.2.2.3. Неполярная ковалентная связь
- •3.2.2.4. Полярная ковалентная связь
- •3.3. Контрольные вопросы
- •2. Как изменяется электроотрицательность элементов в Периодической системе?
- •4. Природа кoвалентной связи
- •4.1. Как взаимодействуют атомные орбитали при образовании молекул?
- •4.2. Молекулярные орбитали
- •4.2.1. Энергия молекулярных орбиталей
- •Влияние несвязывающих молекулярных орбиталей (нсмо) на форму молекул
- •4.2.2.Форма молекулярных орбиталей. - и -мо
- •4.3. Гибридизация атомных орбиталей
- •Vrml-модель (109 822 байт).
- •Vrml-модель (2 камеры, 109 300 байт).
- •Vrml-модель (108 646 байт).
- •4.3.4. Энергия гибридных атомных орбиталей
- •4.4. Моделирование атомных и молекулярных орбиталей с использованием прикладных программ
- •4.5. Механизмы образования ковалентной связи
- •4.6. Донорно-акцепторные связи
- •4.7. Кратные связи
- •4.8. Электронные формулы молекул
- •4.9. Атомно-орбитальные модели
- •4.10. Делокализованные -связи. Сопряжение
- •4.11. Водородные связи (н-связи)
- •Почему связи типа водородных не образуют атомы других элементов?
- •4.11.2. Влияние водородных связей на свойства веществ
- •4.12. Контрольные вопросы
- •9. Укажите тип гибридизации атомов углерода в молекуле:
- •5.1. Классификация соединений по строению углеродной цепи
- •5.2. Классификация соединений по функциональным группам
- •5.3. Контрольные вопросы
- •6. Типы органических реакций
- •6.1. Основные понятия. Химическая реакция
- •6.1.1. Скорость реакции
- •6.1.2. Энергия активации
- •6.1.3. Тепловой эффект реакции
- •6.1.4. Химическое равновесие
- •6.1.5. Катализ
- •6.2. Отличительные особенности органических реакций
- •6.3. Понятие о механизме химической реакции
- •6.4. Классификация органических реакций
- •6.4.1. Классификация реакций по конечному результату
- •6.4.2. Классификация реакций по числу частиц, участвующих в элементарной стадии
- •6.4.3. Классификация реакций по механизму разрыва связей
- •Примеры нуклеофильных реакций
- •Является . . .
- •Панели управления Cosmo Player Панель 1 Панель 2
3.1. Электроотрицательность элементов
Электpоoтрицательность () - способность атома удерживать внешние (валентные) электроны. Она определяется степенью притяжения этих электронов к положительно заряженному ядру.
Это свойство проявляется в химических связях как смещение электронов связи в сторону более электроотрицательного атома.
Электpоотрицательность атомов, участвующих в образовании химической связи, - один из главных факторов, который определяет не только ТИП, но и СВОЙСТВА этой связи, и тем самым влияет на характер взаимодействия между атомами при протекании химической реакции.
В шкале относительных электроотрицательностей элементов Л.Полинга (рассчитанных на основании зависимости энергий связей от различий в электроотрицательностях связываемых атомов) металлы и элементы-органогены располагаются в следующий ряд:
Элемент |
K |
Na |
Li |
Mg |
H |
S |
C |
J |
Br |
Cl |
N |
O |
F |
|
0.8 |
0.9 |
1.0 |
1.2 |
2.1 |
2.5 |
2.5 |
2.5 |
2.8 |
3.0 |
3.0 |
3.5 |
4.0 |
Элeктроотрицательность элементов растет слева направо вдоль периода и снизу вверх в группах Периодической системы Д.И. Менделеева.

3.2. Основные типы химических связей
Основными типами химических связей, отличающихся друг от друга электронным строением и механизмом взаимодействия связываемых атомов, являются ковалентная и ионная связи. Тип связи в значительной степени определяется разностью электроотрицательностей () элементов, участвующих в ее образовании:
= А В,
где А и В - электроотрицательности атомов А и В.
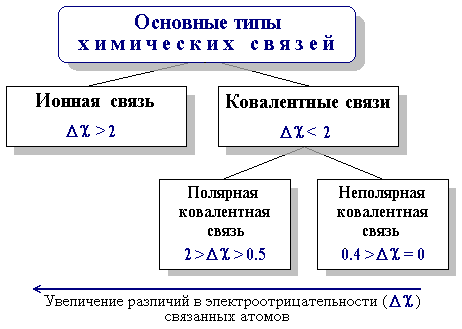
3.2.1. Ионная связь
Химическая связь, основанная на электростатическом притяжении ионов, называется ионной связью
Такая связь возникает при большой разнице в электроотрицательностях связываемых атомов ( > 2 ), когда менее электроотрицательный атом почти полностью отдает свои валентные электроны и превращается в катион, а другой, более электроотрицательный атом, эти электроны присоединяет и становится анионом.
Например, в хлориде натрия NaCl разность электроотрицательностей атомов равна:
= 3.0(Cl) - 0.9(Na) = 2.1.
Атом Na (1 электрон на внешнем уровне) и атом Cl (7 внешних электронов) превращаются в ионы Na+ и Cl- с завершенными внешними электронными оболочками (по 8 электронов), между которыми возникает электростатическое притяжение, т.е. ионная связь.
Иoннaя связь не имеет пространственной направленности, так как каждый ион связан с определенным числом противоионов. Поэтому ионно-связанные соединения не имеют молекулярного строения и представляют собой твердые вещества, образующие ионные кристаллические решетки, с высокими температурами плавления и кипения, они высокополярны, часто солеобразны, в водных растворах электропроводны. Соединений с чисто ионными связями практически не существует.
В органических соединениях ионные связи встречаются довольно редко, т.к. атом углерода не склонен ни терять, ни приобретать электроны с образованием ионов.
