
- •Часть I
- •1. Введение
- •1.1. Углерод
- •1.2. Органические соединения
- •1.3.Значение органической химии
- •Иллюстрация
- •1.4. Контрольные вопросы
- •2. Основы теории строения
- •2.1. Основные положения теории химического строения а.М.Бутлерова
- •2.1.1. Формулы строения
- •2.1.2. Понятие о изомерии
- •2.1.2.1. Структурные изомеры
- •2.1.2.2. Стереоизомеры
- •2.2. Электронные представления в органической химии
- •2.2.1. Свойства электрона
- •2.2.2. Атомные орбитали
- •2.2.3. Форма и энергия атомных орбиталей
- •2.2.4. Заполнение атомных орбиталей электронами
- •2.3. Контрольные вопросы
- •1. Какое из положений теории а.М. Бутлерова объясняет различие в реакциях соединений одинакового состава:
- •2. Изомерами называются . . .
- •3.1. Электроотрицательность элементов
- •3.2. Основные типы химических связей
- •3.2.1. Ионная связь
- •3.2.2. Ковалентная связь
- •3.2.2.1. Свойства ковалентной связи
- •3.2.2.2. Характеристики ковалентной связи
- •3.2.2.3. Неполярная ковалентная связь
- •3.2.2.4. Полярная ковалентная связь
- •3.3. Контрольные вопросы
- •2. Как изменяется электроотрицательность элементов в Периодической системе?
- •4. Природа кoвалентной связи
- •4.1. Как взаимодействуют атомные орбитали при образовании молекул?
- •4.2. Молекулярные орбитали
- •4.2.1. Энергия молекулярных орбиталей
- •Влияние несвязывающих молекулярных орбиталей (нсмо) на форму молекул
- •4.2.2.Форма молекулярных орбиталей. - и -мо
- •4.3. Гибридизация атомных орбиталей
- •Vrml-модель (109 822 байт).
- •Vrml-модель (2 камеры, 109 300 байт).
- •Vrml-модель (108 646 байт).
- •4.3.4. Энергия гибридных атомных орбиталей
- •4.4. Моделирование атомных и молекулярных орбиталей с использованием прикладных программ
- •4.5. Механизмы образования ковалентной связи
- •4.6. Донорно-акцепторные связи
- •4.7. Кратные связи
- •4.8. Электронные формулы молекул
- •4.9. Атомно-орбитальные модели
- •4.10. Делокализованные -связи. Сопряжение
- •4.11. Водородные связи (н-связи)
- •Почему связи типа водородных не образуют атомы других элементов?
- •4.11.2. Влияние водородных связей на свойства веществ
- •4.12. Контрольные вопросы
- •9. Укажите тип гибридизации атомов углерода в молекуле:
- •5.1. Классификация соединений по строению углеродной цепи
- •5.2. Классификация соединений по функциональным группам
- •5.3. Контрольные вопросы
- •6. Типы органических реакций
- •6.1. Основные понятия. Химическая реакция
- •6.1.1. Скорость реакции
- •6.1.2. Энергия активации
- •6.1.3. Тепловой эффект реакции
- •6.1.4. Химическое равновесие
- •6.1.5. Катализ
- •6.2. Отличительные особенности органических реакций
- •6.3. Понятие о механизме химической реакции
- •6.4. Классификация органических реакций
- •6.4.1. Классификация реакций по конечному результату
- •6.4.2. Классификация реакций по числу частиц, участвующих в элементарной стадии
- •6.4.3. Классификация реакций по механизму разрыва связей
- •Примеры нуклеофильных реакций
- •Является . . .
- •Панели управления Cosmo Player Панель 1 Панель 2
2.1.2.1. Структурные изомеры
Структурные изомеры - соединения одинакового качественного и количественного состава, отличающиеся порядком связывания атомов, т.е химическим строением.
Например, составу C5H12 соответствует 3 структурных изомера:

Другой пример:
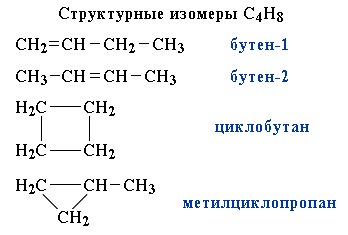
2.1.2.2. Стереоизомеры
Пространственные изомеры (стереоизомеры) при одинаковом составе и одинаковом химическом строении различаются пространственным расположением атомов в молекуле.
Пространственными изомерами являются оптические (зеркальные) и цис-транс изомеры (шарики разного цвета обозначают разные атомы или атомные группы):

Молекулы таких изомеров несовместимы в пространстве.
См. также виртуальные (VRML) модели стереоизомеров: зеркальных (8952 байт) и цис-транс (77111 байт).
Стереоизомерия играет важную роль в органической химии. Подробнее эти вопросы будут рассматриваться при изучении соединений отдельных классов.
2.2. Электронные представления в органической химии
Применение электронной теории строения атома и химической связи в органической химии явилось одним из важнейших этапов развития теории строения органических соединений. Понятие о химическом строении как последовательности связей между атомами (А.М. Бутлеров) электронная теория дополнила представлениями об электронном и пространственном строении и их влиянии на свойства органических соединений. Именно эти представления дают возможность понять способы передачи взаимного влияния атомов в молекулах (электронные и пространственные эффекты) и поведение молекул в химических реакциях.
Согласно современным представлениям свойства органических соединений определяются:
природой и электронным строением атомов;
типом атомных орбиталей и характером их взаимодействия;
типом химических связей;
химическим, электронным и пространственным строением молекул.
2.2.1. Свойства электрона
Электрон имеет двойственную природу. В разных экспериментах он может проявлять свойства как частицы, так и волны. Движение электрона подчиняется законам квантовой механики.
Связь между волновыми и корпускулярными свойствами электрона отражает соотношение де Бройля:
=h/mv ,
где - длина волны электрона; m - его масса; v - скорость; h = 6.6210-34 Джс - постоянная Планка.
Положение и скорость электрона невозможно одновременно измерить с абсолютной точностью (принцип неопределенности Гейзенберга). Поэтому движение электрона в атоме или в молекуле нельзя описать с помощью траектории. Электрон может находиться в любой точке пространства, но с разной вероятностью.
Часть пространства, в котором велика вероятность нахождения электрона, называют орбиталью или электронным облаком. Например:
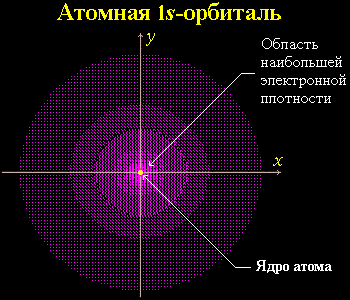
2.2.2. Атомные орбитали
Атомная орбиталь (АО) - область наиболее вероятного пребывания электрона (электронное облако) в электрическом поле ядра атома.
Положение элемента в Периодической системе определяет тип орбиталей его атомов (s-, p-, d-, f-АО и т.д.), различающихся энергией, формой, размерами и пространственной направленностью.
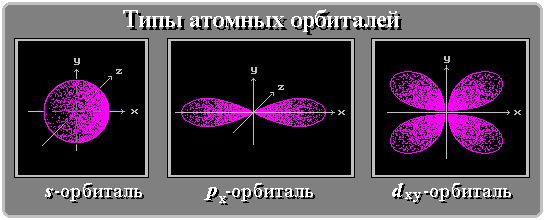
Для элементов 1-го периода (Н, He) характерна одна АО - 1s.
В элементах 2-го периода электроны занимают пять АО на двух энергетических уровнях: первый уровень 1s; второй уровень - 2s, 2px, 2py, 2pz. (цифры обозначают номер энергетического уровня, буквы - форму орбитали).
Состояние электрона в атоме полностью описывают квантовые числа.

Квантовые числа - энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l =1 - р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 - d-орбиталями (5 типов), l = 3 - f-орбиталями (7 типов).
Магнитное квантовое число m определяет направление орбитали в пространстве. Его значения изменяются от +l до - l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: px, py, pz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона.
