
- •3. Формула Релея-Джинса.
- •17.Соотношение неопределенностей Гейзенберга и волновые свойства микрочастиц. Наборы одновременно измеримых величин.
- •18.Временное уравнение Шредингера. Стационарное уравнение Шредингера. Стационарные состояния.
- •Адиабата Пуассона
- •Основное уравнение мкт
- •Закон о суммарном давлении смеси газов
- •Закон о растворимости компонентов газовой смеси
- •Виды теплообмена
Адиабата Пуассона
Для идеальных газов, чью теплоёмкость можно считать постоянной, в случае квазистатического процесса адиабата имеет простейший вид и определяется уравнением[5][14][15]
![]()
где
![]() —
его объём,
—
его объём,
![]() —
показатель
адиабаты,
—
показатель
адиабаты,
![]() и
и
![]() —
теплоёмкости
газа соответственно при постоянном
давлении и постоянном объёме.
—
теплоёмкости
газа соответственно при постоянном
давлении и постоянном объёме.
С учётом уравнения состояния идеального газа уравнение адиабаты может быть преобразовано к виду
![]()
где T — абсолютная температура газа. Или к виду
![]()
Поскольку
![]() всегда
больше 1, из последнего уравнения
следует, что при адиабатическом сжатии
(то есть при уменьшении V)
газ нагревается (T
возрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов. Нагревание при сжатии
больше для того газа, у которого больше
коэффициент
.
всегда
больше 1, из последнего уравнения
следует, что при адиабатическом сжатии
(то есть при уменьшении V)
газ нагревается (T
возрастает), а при расширении —
охлаждается, что всегда верно и для
реальных газов. Нагревание при сжатии
больше для того газа, у которого больше
коэффициент
.
Политропный процесс это процесс, в котором теплоемкость остается постоянной. Политропным процессом являются изохорный, изобарный, изотермический и адиабатный процессы, потому что все они имеют общую особенность - они происходят при постоянной теплоемкости.
Политропа
это график зависимости между параметрами
состояния идеального газа при
![]() .
Политропа в координатах p, V - гипербола,
занимающая промежуточное положение
между изотермой и адиабатой.
.
Политропа в координатах p, V - гипербола,
занимающая промежуточное положение
между изотермой и адиабатой.
Исходя
из первого начала термодинамики при
условии постоянства теплоемкости (
),
можно вывести уравнение политропы:
![]() -
уравнение
политропы,
-
уравнение
политропы,
Билет 22
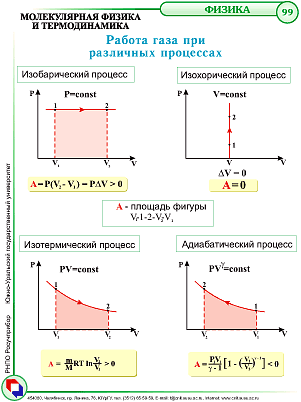
Основное уравнение мкт
![]() ,
где k
является постоянной
Больцмана
(отношение универсальной
газовой постоянной
R
к числу
Авогадро
NA),
i
— число степеней свободы молекул (i
= 3
в большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T
- абсолютная температура.
,
где k
является постоянной
Больцмана
(отношение универсальной
газовой постоянной
R
к числу
Авогадро
NA),
i
— число степеней свободы молекул (i
= 3
в большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T
- абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Абсолютная термодинамическая температура- температура Т, отсчитываемая от абсолютного нуля. Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры - кельвин (К). 1К = 1 °С. Значения абсолютной температуры связаны с температурой по Цельсия шкале (t °С) соотношением t = Т - 273,15 К. Термометрическое тело - вещество, физические параметры которого зависят от его температуры. Такие вещества используются в термометрах. Шкала Кельвина В термодинамике используется шкала Кельвина, в которой температура отсчитывается от абсолютного нуля (состояние, соответствующее минимальной теоретически возможной внутренней энергии тела), а один кельвин равен 1/273.16 расстояния от абсолютного нуля до тройной точки воды (состояния, при котором лёд, вода и водяной пар находятся в равновесии). Для пересчета кельвинов в энергетические единицы служит постоянная Больцмана. Используются также производные единицы: килокельвин, мегакельвин, милликельвин и т.д.
Шкала Цельсия В быту используется шкала Цельсия, в которой за 0 принимают точку замерзания воды, а за 100° точку кипения воды при атмосферном давлении. Поскольку температура замерзания и кипения воды недостаточно хорошо определена, в настоящее время шкалу Цельсия определяют через шкалу Кельвина: градус Цельсия равен кельвину, абсолютный ноль принимается за −273,15 °C. Шкала Цельсия практически очень удобна, поскольку вода очень распространена на нашей планете и на ней основана наша жизнь. Ноль Цельсия — особая точка для метеорологии, поскольку замерзание атмосферной воды существенно всё меняет.
Шкала Реомюра Предложенна в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°R), 1 °R равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °R) и кипения воды (80 °R)1 °R = 1,25 °C.В настоящее время шкала вышла из употребления, дольше всего она сохранялась во Франции, на родине автора.
Билет 23
Парциа́льное давление (лат. partialis — частичный, от лат. pars — часть) — давление отдельно взятого компонента газовой смеси.[1] Общее давление газовой смеси является суммой парциальных давлений её компонентов.
Законы Дальтона
