
- •Тиаминдифосфат выполняет функцию простетической группы ферментов – декарбоксилаз, участвующих в метаболизме пирувата и альфа-кетогрутората
- •15. Биотин и витамин в12. Роль этих витаминов в биосинтезах.
- •16. Особенности строения надф и его роль в метаболизме.
- •17. Строение фад и его роль в клеточном метаболизме.
- •18. Фосфопиридоксаль и его роль в клеточном метаболизме. Представление о реакциях трансаминирования.
- •21, 22 Пантотеновая кислота, ее строение и роль в метаболизме. Пантотеновая кислота (вит в3)- явл комплексным соединением β-аланина и 2,4-диокси-3,3-диметил масляной к-ты.
- •23, 24 Фолиевая кислота, ее строение и биологическая роль.
- •26. Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере трансаминаз и дегидрогеназ, витаминов в6, рр, b2).
- •29. Витамины в2 и рр их химическое строение и роль в клеточном метаболизме.
29. Витамины в2 и рр их химическое строение и роль в клеточном метаболизме.
Витамин РР(Никотиновая к-та) -соединение пиридинового ряда, содерж карбоксильную гр (никотинамид отлич наличием амидной гр).
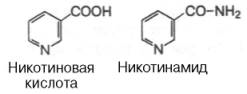
РР малорастворим в воде (примерно 1%), но хор растворим в водных р-рах щелочей. Вит кристаллизуется в виде белых игл. Наиб характерными признаками авитаминоза РР, т.е. пеллагры явл поражения кожи (дерматиты), пищеварит тракта (диарея) и нар нервн деятельности (деменция). Биологическая роль-РР вход в состав НАД или НАДФ, явл коферментами многих обратимо действ в окисл-восстановит. реакциях дегидрогеназ.
44)НАДФ и НАД: Никотинамидадениндинуклеотидфосфат (НАДФ)- участв в реакциях окисл — восстановл. Структура НАДФ служит акцептором водорода при окисл углеводов; в восстановленной форме явл донором водорода при биосинтезе жирных к-т. В хлоропластах растит кл НАДФ восстанавл-ся при световых реакциях фотосинтеза. НАД (никотинамидадениндинуклеотид)- кофермент, присутств во всех живых кл; входит в состав ферментов гр дегидрогеназ, катализирующих окисл-восстановительные реакции.
Во многих окисл-восстанов реакциях НАД или НАДФ присоедин протон и 2 электрона, переносимые от окисляемого субстрата к окисленному коферменту; в обратной реакции водород переносится от восстановл кофермента к субстрату. При этом водород отщепл-ся и присоед-ся к атому углерода амида никотиновой кислоты в 4-м положении:
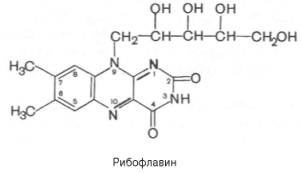
В
основе лежит гетероциклич
соединение
изоаллоксазин (сочет бензольного,
пиразинового и пиримидинового колец),
к кот в полож 9 присоединен пятиатомный
спирт
риби-тол.
Рибофлавин
хор раствор в воде,
устойчив в кислых р-рах,но
легко разруш-ся в нейтр и щелочных р-рах.
Он весьма чувствителен к видимому и
УФ-излучению и сравнит легко подвергается
обратимому восстан-ию,
присоединяя водород
по месту двойных
связей
и превращаясь в бесцветную лейкоформу.
Это свойство
рибофлавина
легко окисляться и восстанавливаться
лежит в основе его биологического
действия в клеточном метаболизме.
Клинич проявл
недостаточности
рибофлавина
на эксперимент животных.Помимо остановки
роста, выпадения волос(алопеция),
характерных воспалит проц слизистой
оболочки языка (глоссит), губ, особенно
у углов рта, эпителия
кожи.
 Биологич роль-Рибофлавин
входит в состав флавиновых коферментов,
в частности ФМН и ФАД , являющ в свою
очередь простетическими гр ферментов
ряда других сложн б
– флавопротеинов.
Биологич роль-Рибофлавин
входит в состав флавиновых коферментов,
в частности ФМН и ФАД , являющ в свою
очередь простетическими гр ферментов
ряда других сложн б
– флавопротеинов.
Во флавиновых коферментах (ФАД-флавинмононуклеотид или ФМН-флавинаденинуклеотид), активной частью мол кот явл изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюд присоедин 2 протонов и 2 электронов одновременно:
Восстановл формы этих кофакторов способны транспортировать водород и электроны к дых цепи митох или иных энерго-сопрягающих мембран.
