
- •25. Частота столкновений молекул идеального газа. Средняя длина свободного пробега газовых молекул.
- •26. Явления переноса: диффузия, внутреннее трение, теплопроводность.
- •27. Испарение и кипение жидкостей. Насыщенный пар. Влажность воздуха. Точка росы.
- •28. Учет объема газовых молекул сил межмолекулярного взаимодействия. Реальные газы. Уравнение Ван-дер-Ваальса.
- •29. Теоретические и опытные изотермы реального газа. Критические параметры.
29. Теоретические и опытные изотермы реального газа. Критические параметры.
Для исследования поведения реального газа рассмотрим изотермы Вандер-Ваальса — кривые зависимости р от Vm при заданных Т, определяемые уравнением Ван-дер-Ваальса (1) для 1 моль газа. Эти кривые (рассматриваются для четырех различных температур имеют довольно своеобразный характер.
При высоких температурах (Т > Тк) изотерма реального газа отличается от изотермы идеального
газа только некоторым искажением ее формы, оставаясь монотонно спадающей кривой. При некоторой температуре Тк на изотерме имеется лишь одна точка перегиба К. Эта изотерма назы вается критической, соответствующая ей температура Тк — критической температурой; точка перегиба К называется критической точкой; в этой точке касательная к ней параллельна оси абсцисс. Соответствующие этой точке объем Vк и давление рк называются также критическими.
Состояние с критическими параметрами (рк, Vк,, Tк) называется критическим состоянием. При низких температурах ( Т < Тк) изотермы имеют волнообразный участок, сначала монотонно опускаясь вниз, затем монотонно поднимаясь вверх и снова монотонно опускаясь.
Для пояснения характера изотерм преобразуем уравнение Ван-дер-Ваальса (1) к виду
 .(2)
.(2)
Уравнение (2) при заданных р и Т является уравнением третьей степени относительно Vm; следовательно, оно может иметь либо три вещественных корня, либо один вещественный и
два мнимых, причем физический смысл имеют лишь вещественные положительные корни. Поэтому первому случаю соответствуют изотермы при низких температурах (три значения объема
газа V1, V2 и V3) отвечают (индекс m для простоты опускаем) одному значению давления р1, второму случаю - изотермы при высоких температурах.
Рассматривая различные участки изотермы при Т < Тк (рис. 2), видим, что на участках 1—З и 5—7 при уменьшении объема Vm давление р растет, что естественно. На участке 3 — 5 сжатие вещества приводит к уменьшению давления; практика же показывает, что такие состояния в природе не осуществляются. Наличие участка 3 — 5 означает, что при постепенном изменении объема
вещество не может оставаться все время в виде однородной среды; в некоторый момент должно наступить скачкообразное изменение состояния и распад вещества на две фазы. Таким образом,
истинная изотерма будет иметь вид ломаной линии 7—6 — 2—1. Часть 6—7 отвечает газообразному состоянию, а часть 2—1 — жидкому. В состояниях, соответствующих горизонтальному участку изотермы 6 — 2, наблюдается равновесие жидкой и газообразной фаз вещества. Вещество в газообразном состоянии при температуре ниже критической называется паром, а пар, находящийся в равновесии со своей жидкостью, называется насыщенным.
Данные выводы, следующие из анализа уравнения Ван-дер-Ваальса, были подтверждены опытами ирландского ученого Т. Эндрюса (1813— 1885), изучавшего изотермическое сжатие углекислого газа. Отличие экспериментальных (Эндрюс) и теоретических (Ван-дер-Ваальс) изотерм заключается в том, что превращению газа в жидкость в первом случае соответствуют горизонтальные участки, а во втором — волнообразные. Для нахождения критических пара-
метров
подставим их значения в уравнение (2) и
запишем
 (3)
(3)
(символ
m
для простоты опускаем). Поскольку
в критической точке все три корня
совпадают и равны Vк,
уравнение
приводится к виду
 или
или
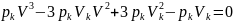 (4).
(4).
Так
как уравнения (3) и (4) тождественны, то
в них должны быть равны и коэффициенты
при неизвестных соответствующих
степеней. Поэтому можно записать
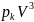 =ab,
=ab, =a,
=a,
 =
= .
Решая полученные уравнения, найдем
.
Решая полученные уравнения, найдем
 ,
,
 =
= ,
,
 .
.
Если через крайние точки горизонтальных участков семейства изотерм провести линию, то получится колоколообразная кривая (рис.3), ограничивающая область двухфазных состояний вещества. Эта кривая и критическая изотерма делят диаграмму р, Vm под изотермой на три области: под колоколообразной кривой располагается область двухфазных состояний
(жидкость и насыщенный пар), слева от нее находится область жидкого состояния, а справа область пара. Пар отличается от остальных газообразных состояний тем, что при изотермическом сжатии претерпевает процесс сжижения. Газ же при температуре выше критической не может быть превращен в жидкость ни при каком давлении.
Сравнивая изотерму Ван-дер-Ваальса с изотермой Эндрюса (верхняя кривая на рис. 4), видим, что последняя имеет прямолинейный участок 2 — 6, соответствующий двухфазным состояниям вещества. Правда, при некоторых условиях могут быть реализованы состояния, изображаемые участками ван-дер-ваальсовой изотермы 5—6 и 2—3. Эти неустойчивые состояния называются метастабилъными. Участок 2—3 изображает перегретую жидкость, 5—6 — пересыщенный пар. Обе фазы ограниченно устойчивы. При достаточно низких температурах изотерма пересекает ось Vm, переходя в область отрицательных давлений (нижняя кривая на рис. 4). Вещество под отрицательным давлением находится в состоянии растяжения. При некоторых условиях такие состояния также реализуются. Участок 8 — 9 на нижней изотерме соответствует перегретой жидкости, участок 9—10 — растянутой жидкости.
![]() Рис
1
Рис
1![]() Рис
2
Рис
2
 Рис
3
Рис
3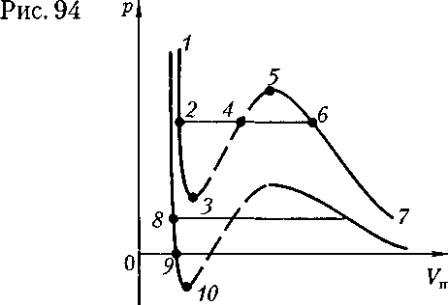 Рис
4
Рис
4
30. Энтропия и её статистическая интерпретация. Связь энтропии и вероятности состояния. Возрастание энтропии при неравновесных процессах. Границы применимости второго закона термодинамики. Понятие о термодинамике открытых систем.
Понятие энтропии введено в 1865 г. Р. Клаузиусом. Для выяснения физического содержания этого понятия рассматривают отношение теплоты Q, полученной телом в изотермическом процессе, к температуре Т теплоотдающего тела, называемое приведенным количеством теплоты.
Приведенное
количество теплоты, сообщаемое телу
на бесконечно малом участке процесса,
равно
 . Строгий теоретический анализ показывает,
что приведенное количество теплоты,
сообщаемое телу в
любом обратимом круговом процессе,
равно
. Строгий теоретический анализ показывает,
что приведенное количество теплоты,
сообщаемое телу в
любом обратимом круговом процессе,
равно
 .
.
Из
равенства нулю интеграла (1), взятого
по замкнутому контуру, следует, что
подынтегральное выражение — есть
полный дифференциал некоторой функции,
которая определяется только состоянием
системы и не зависит от пути, каким
система пришла в это состояние. Таким
образом,
 (2)
(2)
Функция
состояния, дифференциалом
которой является
,
называется энтропией
и обозначается
S.
Из формулы (1) следует, что для обратимых
процессов изменение
энтропии
 .(3)
.(3)
В
термодинамике доказывается, что энтропия
системы, совершающей необратимый
цикл, возрастает:
 .(4)
.(4)
Выражения
(3) и (4) относятся только к замкнутым
системам, если
же система обменивается теплотой с
внешней средой, то ее энтропия может
вести себя любым образом. Соотношения
(3) и (4) можно представить в виде неравенства
Клаузиуса:
 (5)
т.е. энтропия
замкнутой системы может либо возрастать
(в случае
необратимых процессов), либо
оставаться постоянной (в
случае обратимых процессов).
(5)
т.е. энтропия
замкнутой системы может либо возрастать
(в случае
необратимых процессов), либо
оставаться постоянной (в
случае обратимых процессов).
Если
система совершает равновесный переход
из состояния 1
в состояние
2, то, согласно (2), изменение энтропии
 (6), где подынтегральное выражение и
пределы интегрирования определяются
через величины, характеризующие
исследуемый процесс. Формула (6) определяет
энтропию с точностью до аддитивной
постоянной. Физический
смысл имеет не сама энтропия, а
разность
энтропий.
(6), где подынтегральное выражение и
пределы интегрирования определяются
через величины, характеризующие
исследуемый процесс. Формула (6) определяет
энтропию с точностью до аддитивной
постоянной. Физический
смысл имеет не сама энтропия, а
разность
энтропий.
Исходя
из выражения (6), найдем изменение
энтропии в
процессах
идеального газа. Т.к.
 то
то
 (7), т. е. изменение энтропии
(7), т. е. изменение энтропии идеального
газа при переходе его из состояния 1
в состояние
2 не зависит
от вида
процесса
перехода 1
идеального
газа при переходе его из состояния 1
в состояние
2 не зависит
от вида
процесса
перехода 1 2.
2.
Так
как для адиабатного процесса
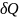 =
0, то
=
0, то
 = 0 и,
следовательно, S
= const, т. е.
адиабатный
обратимый
процесс
протекает
при постоянной
энтропии. Поэтому
его часто называют изоэнтропийным
процессом. Из
формулы (7) следует, что при изотермическом
процессе (T1=T2)
= 0 и,
следовательно, S
= const, т. е.
адиабатный
обратимый
процесс
протекает
при постоянной
энтропии. Поэтому
его часто называют изоэнтропийным
процессом. Из
формулы (7) следует, что при изотермическом
процессе (T1=T2)
 ;при
изохорном процессе ( V1
= V2)
;при
изохорном процессе ( V1
= V2)
 .
.
Энтропия обладает свойством аддитивности: энтропия системы равна сумме энтропий тел, входящих в систему. Более глубокий смысл энтропии вскрывают в статистической физике: энтропия связывается с термодинамической вероятностью состояния системы. Термодинамическая вероятность W состояния системы — это число способов, которыми может быть реализовано данное состояние макроскопической системы, или число микросостояний, осуществляющих данное макросостояние.
Согласно
Больцману, энтропия
системы и
термодинамическая
вероятность связаны
между собой следующим образом:
 (8),
где к
— постоянная
Больцмана.
(8),
где к
— постоянная
Больцмана.
Таким образом, энтропия определяется логарифмом числа микросостояний, с помощью которых может быть реализовано данное макросостояние.
Следовательно, энтропия может рассматриваться как мера вероятности состояния термодинамической системы. Формула Больцмана (8) позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы.
В самом деле, чем больше число микросостояний, реализующих данное макросостояние, тем больше энтропия. В состоянии равновесия — наиболее вероятного состояния системы — число
микросостояний максимально, при этом максимальна и энтропия. Так как реальные процессы необратимы, то можно утверждать, что все процессы в замкнутой системе ведут к увеличению ее энтропии — принцип возрастания энтропии. При статистическом толковании энтропии это означает, что процессы в замкнутой системе идут в направлении увеличения числа микросостояний, иными словами, от менее вероятных состояний к более вероятным — до тех пор, пока вероятность состояния не станет максимальной.
Сопоставляя выражения (5) и (8), видим, что энтропия и термодинамическая вероятность состояний замкнутой системы могут либо возрастать (в случае необратимых процессов),
либо оставаться постоянными (в случае обратимых процессов). Для «малых» систем
могут наблюдаться флуктуации, т.е. энтропия и термодинамическая вероятность состояний замкнутой системы на определенном отрезке времени могут убывать, а не возрастать, или оставаться постоянными.
Появление второго начала термодинамики связано с необходимостью дать ответ на вопрос, какие процессы в природе возможны, а какие нет. Второе начало термодинамики определяет направление протекания термодинамических процессов.
Используя понятие энтропии и неравенство Клаузиуса, второе начало термодинамики можно сформулировать как закон возрастания энтропии замкнутой системы при необратимых процессах: любой необратимый процесс в замкнутой системе происходит так, что энтропия системы при этом возрастает. Можно дать более краткую формулировку второго начала термодинамики: в процессах, происходящих в замкнутой системе, энтропия не убывает. Речь идет о замкнутых системах, так как в незамкнутых системах энтропия может вести себя любым образом (убывать, возрастать, оставаться постоянной). Кроме того, энтропия остается постоянной в замкнутой системе только при обратимых процессах. При необратимых процессах в замкнутой системе энтропия всегда возрастает.
Формула Больцмана (8) позволяет объяснить постулируемое вторым началом термодинамики возрастание энтропии в замкнутой системе при необратимых процессах: возрастание энтропии означает переход системы из менее вероятных в более вероятные состояния. Таким образом, формула Больцмана позволяет дать статистическое толкование второго начала термодинамики. Оно, являясь статистическим законом, описывает закономерности хаотического движения большого числа частиц, составляющих замкнутую систему.
С точки зрения статистической физики второе начало термодинамики имеет статистический характер: оно справедливо для наиболее вероятного поведения системы. Существование флуктуаций препятствует точному его выполнению, однако вероятность сколь-нибудь значительного нарушения крайне мала.
