
- •Вопрос 1 Равномерное прямолинейное движение. Равнопеременное прямолинейное движение
- •Вопрос6 Законы сохранения в механике
- •Вопрос 7 Механические колебания и их характеристики. Гармонические колебания.
- •Вопрос 11 Идеальный газ. Давление газа. Основное уравнение мкт идеального газа.
- •Вопрос 12 Уравнение состояния идеального газа ( уравнение Менделеева- Клапейрона). Законы идеальных газов. Изопроцессы.
- •4. Адиабатический процесс (изоэнтропийный):
- •8.Объединённый газовый закон (Закон Клапейрона).
- •Вопрос13 Внутренняя энергия и способы ее измерения. Количество теплоты, выделяющееся при сгорании топлива.
- •Вопрос 14 Изменение внутренней энергии при нагревании и охлаждении. Работа газа при изменении обьема.
- •Вопрос 15 Условия равновесия тела. Момент силы. Виды равновесия.
- •Вопрос 16 Парообразование и конденсация. Испарение. Кипение жидкости. Зависимость кипения жидкости от давления.
- •Вопрос 17 Насыщенный пар и его свойства.
- •Свойства
- •Вопрос 18 Влажность воздуха. Точка росы. Приборы определения влажности воздуха.
- •Вопрос 19 Свойства жидкостей. Поверхностное натяжение. Смачивание. Капиллярность.
- •Вопрос 20 Свойства твёрдых тел. Виды кристалических структур. Плавление и кристализация.
- •Вопрос 21 Электризация тел. Закон сохранения заряда. Распределение заряда по поверхности проводника.
- •Закон сохранения заряда в интегральной форме
- •Закон сохранения заряда в дифференциальной форме
- •Закон сохранения заряда в электронике
- •Закон сохранения заряда и калибровочная инвариантность
- •Вопрос 22 Взаимодействие точечных зарядов. Закон Кулона.
- •Вопрос 23 Электрическое поле. Напряжённость электрического поля. Графическое изображение электрических полей.
- •Вопрос 24 Работа электрического поля при перемещении заряда. Потенциал.
- •Вопрос 25 Разность потенциалов. Связь между напряжённостью и разностью потенциалов.
- •Вопрос 26 Электроёмкость. Конденсаторы и их виды. Соединение конденсаторов.
- •Вопрос 27 Условия возникновения тока. Сила и плотность тока. Источник тока. Замкнутая электрическая цепь, её внешние и внутренние участки.
- •Вопрос 28 Постоянный ток. Закон Ома для участка цепи без эдс. Сопротивление. Зависимость сопротивления металла от температуры.
Вопрос 11 Идеальный газ. Давление газа. Основное уравнение мкт идеального газа.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
Свойства идеального газа на основе молекулярно-кинетических представлений определяются исходя из физической модели идеального газа, в которой приняты следующие допущения:
объём частицы газа равен нулю (то есть, диаметр молекулы
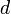 пренебрежимо мал по сравнению со средним
расстоянием между ними,
пренебрежимо мал по сравнению со средним
расстоянием между ними,
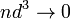 )
[1];
)
[1];импульс передается только при соударениях (то есть, силы притяжения между молекулами не учитываются, а силы отталкивания возникают только при соударениях);
суммарная энергия частиц газа постоянна (то есть, нет передачи энергии за счет передачи тепла или излучения)
Давле́ние (P) — физическая величина, равная силе F, действующей на единицу площади поверхности S перпендикулярно этой поверхности. В данной точке давление определяется как отношение нормальной составляющей силы Fn, действующей на малый элемент поверхности, к его площади:
![]()
Среднее давление по всей поверхности есть отношение силы к площади поверхности:
![]()
Давление характеризует состояние сплошной среды и является диагональной компонентой тензора напряжений. В простейшем случае изотропной равновесной неподвижной среды давление не зависит от ориентации. Давление можно считать также мерой запасённой в сплошной среде потенциальной энергии на единицу объёма и измерять в единицах энергии, отнесённых к единице объёма.
Вопрос 12 Уравнение состояния идеального газа ( уравнение Менделеева- Клапейрона). Законы идеальных газов. Изопроцессы.
В этом случае частицы газа движутся независимо друг от друга, давление газа на стенку равно сумме импульсов в единицу времени, переданной при столкновении частиц со стенкой, энергия — сумме энергий частиц газа. Свойства идеального газа описываются уравнением Менделеева — Клапейрона
![]()
где
![]() — давление,
— давление,
![]() — концентрация частиц,
— концентрация частиц,
![]() — постоянная Больцмана,
— абсолютная температура.
— постоянная Больцмана,
— абсолютная температура.
Для любого идеального газа справедливо
соотношение Майера:
![]()
где
![]() — универсальная газовая постоянная,
— универсальная газовая постоянная,
![]() — молярная теплоемкость при постоянном
давлении,
— молярная теплоемкость при постоянном
давлении,
![]() — молярная теплоемкость при постоянном
объёме.
— молярная теплоемкость при постоянном
объёме.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
В случае постоянной массы газа уравнение
можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
![]() — Закон Гей-Люссака
— Закон Гей-Люссака
![]() — закон Шарля (второй закон Гей-Люссака,
1808 г.)
— закон Шарля (второй закон Гей-Люссака,
1808 г.)
Законы идеальных газов
Изопроцессы идеального газа – процессы, при которых один из параметров остаётся неизменным.
1. Изохорический процесс. Закон Шарля. V = const.
Изохорическим процессом называется процесс, протекающий при постоянном объёме V. Поведение газа при этом изохорическом процессе подчиняется закону Шарля:
При постоянном объёме и неизменных значениях массы газа и его молярной массы, отношение давления газа к его абсолютной температуре остаётся постоянным: P/Т = const.
2. Изобарический процесс. Закон Гей-Люссака. Р = const.
Изобарическим процессом называется процесс, протекающий при постоянном давлении Р. Поведение газа при изобарическом процессе подчиняется закону Гей-Люссака:
При постоянном давлении и неизменных значениях массы и газа и его молярной массы, отношение объёма газа к его абсолютной температуре остаётся постоянным: V/T = const.
3. Изотермический процесс. Закон Бойля – Мариотта. T = const. Изотермическим процессом называется процесс, протекающий при постоянной температуре Т.
Поведение идеального газа при изотермическом процессе подчиняется закону Бойля – Мариотта: T = const.
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
Уравнение изотермы:
![]()
