
- •Материя, пространство, время, абсолютность и относительность движения, системы отсчёта.
- •Кинематика поступательного движения, материальная точка.
- •Различные варианты механического движения тангенциальное и нормальное ускорения.
- •Кинематика вращательного движения абсолютно твёрдого тела.
- •Первый закон Ньютона, инерциальные и неинерциальные системы отсчёта, инертность, силы инерции.
- •Второй закон Ньютона (две формулировки). Сила, импульс тела, импульс силы.
- •Третий закон Ньютона, границы применимости законов классической механики.
- •Работа и мощность при поступательном движении тела.
- •Механическая энергия, кинетическая и потенциальная.
- •Закон сохранения импульса замкнутой системы, закон сохранения энергии замкнутой системы при упругом и неупругом ударах.
- •11. Силы в механике (упругости, трения, тяготения).
- •Второй закон Ньютона для вращательного движения (две формулы), момент силы, момент инерции.
- •Работа, мощность и кинетическая энергия при вращательном движении.
- •Законы сохранения момента импульса и кинетической энергии замкнутой системы тел.
- •Атомно-молекулярная теория строения вещества, принципы мкт. Уравнение состояния термодинамической системы, параметр состояния (p, V, t), физический смысл t.
- •Уравнение состояния идеального газа, основное уравнение мкт газа.
- •Внутренняя энергия идеального газа и методы её изменения (теплообмен и работа).
- •Первое начало термодинамики (первое начало для четырёх процессов: изотермический, изохорный, изобарный и адиобатный).
- •Термодинамический цикл, цикл Карно, тех. Циклы.
- •Второе начало термодинамики для теплового двигателя идеальной тепловой машины, идеальный холодильник, кпд тепловой машины.
- •Реальные газы, уравнение Ван-Дер-Ваальса, физический смысл поправок а и б, внутренняя энергия реального газа.
- •Энтропия, второй закон термодинамики (общая формулировка). Статистическое толкование второго начала, связь энтропии и вероятности состояния системы, «тепловая смерть вселенной».
Уравнение состояния идеального газа, основное уравнение мкт газа.
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа, согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
Рассмотрим законы, описывающие поведение идеальных газов.
Закон Бойля—Мариотта*: для данной массы газа при постоянной температуре произведение давления газа на его объем есть величина постоянная:
при
 ,
,

Законы Гей-Люссака*: 1) объем данной массы газа при постоянном давлении изменяется линейно с температурой:
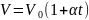 при
при
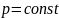 ,
,
2) давление данной массы газа при постоянном объеме изменяется линейно с температурой:
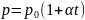 при
при
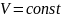 ,
,
В этих уравнениях t — температура по шкале Цельсия, р0 и V0 — давление и объем при 0°С, коэффициент = 1/273,15 К–1.
Абсолютный ноль – температура, при которой прекращается движение молекул:
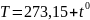
Закон Авогадро*: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы. При нормальных условиях этот объем равен 22,4110–3 м3/мол
По определению, в одном моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро:
![]()
Уравнение состояния идеального газа (Клапейрона-Менделеева)

R – молярная газовая постоянная, равная 8,31 Дж/(моль*К)
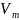 - молярный объём,
равный 22,41*10-3
м3/моль
- молярный объём,
равный 22,41*10-3
м3/моль
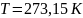
Основное уравнение МКТ газа – уравнение, связывающее давление газа со скоростью его частиц.
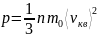
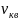 - средняя квадратичная
скорость
- средняя квадратичная
скорость
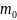 - масса молекулы
- масса молекулы
n – концентрация молекул
Внутренняя энергия идеального газа и методы её изменения (теплообмен и работа).
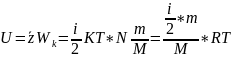
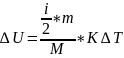
M – молярная масса
К = R/Na
Способы изменения внутренней энергии газа:
Теплообмен
Работа
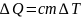
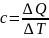
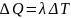
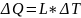
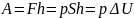

Первое начало термодинамики (первое начало для четырёх процессов: изотермический, изохорный, изобарный и адиобатный).
![]()
или
![]()
Уравнение выражает первое начало термодинамики: теплота, сообщаемая системе, расходуется на изменение ее внутренней энергии и на совершение ею работы против внешних сил.
При А = 0 Q=ΔU
При Q = 0 A = -ΔU
При ΔU = 0 A = Q
Применение первого начала для четырёх процессов изложено в вопросе 16, или см. параграф 55 в учебнике Трофимовой.
Термодинамический цикл, цикл Карно, тех. Циклы.
Круговым процессом (или циклом) называется процесс, при котором система, пройдя через ряд состояний, возвращается в исходное.
Р абочий
цикл идеальной тепловой машины:
абочий
цикл идеальной тепловой машины:

1 моль
идеального газа
Нагреватель
Нагреватель отсутствует, а поршень всё ещё поднимается
1


Холод
Поршень возвращается в исходное положение.

Цикл Карно
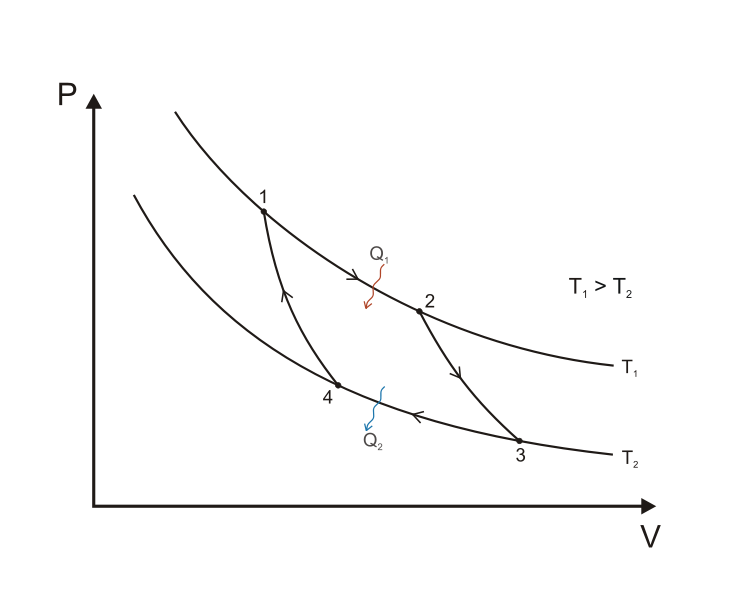
Цикл Карно состоит из четырёх стадий:
Изотермическое расширение (1-2).
Адиабатическое (изоэнтропическое) расширение (2-3).
Изотермическое сжатие (3-4).
Адиабатическое сжатие (4-1).
