
- •Материя, пространство, время, абсолютность и относительность движения, системы отсчёта.
- •Кинематика поступательного движения, материальная точка.
- •Различные варианты механического движения тангенциальное и нормальное ускорения.
- •Кинематика вращательного движения абсолютно твёрдого тела.
- •Первый закон Ньютона, инерциальные и неинерциальные системы отсчёта, инертность, силы инерции.
- •Второй закон Ньютона (две формулировки). Сила, импульс тела, импульс силы.
- •Третий закон Ньютона, границы применимости законов классической механики.
- •Работа и мощность при поступательном движении тела.
- •Механическая энергия, кинетическая и потенциальная.
- •Закон сохранения импульса замкнутой системы, закон сохранения энергии замкнутой системы при упругом и неупругом ударах.
- •11. Силы в механике (упругости, трения, тяготения).
- •Второй закон Ньютона для вращательного движения (две формулы), момент силы, момент инерции.
- •Работа, мощность и кинетическая энергия при вращательном движении.
- •Законы сохранения момента импульса и кинетической энергии замкнутой системы тел.
- •Атомно-молекулярная теория строения вещества, принципы мкт. Уравнение состояния термодинамической системы, параметр состояния (p, V, t), физический смысл t.
- •Уравнение состояния идеального газа, основное уравнение мкт газа.
- •Внутренняя энергия идеального газа и методы её изменения (теплообмен и работа).
- •Первое начало термодинамики (первое начало для четырёх процессов: изотермический, изохорный, изобарный и адиобатный).
- •Термодинамический цикл, цикл Карно, тех. Циклы.
- •Второе начало термодинамики для теплового двигателя идеальной тепловой машины, идеальный холодильник, кпд тепловой машины.
- •Реальные газы, уравнение Ван-Дер-Ваальса, физический смысл поправок а и б, внутренняя энергия реального газа.
- •Энтропия, второй закон термодинамики (общая формулировка). Статистическое толкование второго начала, связь энтропии и вероятности состояния системы, «тепловая смерть вселенной».
Работа, мощность и кинетическая энергия при вращательном движении.
Кинетическая энергия вращающегося тела равна сумме кинетических энергий его элементарных объёмов, откуда:
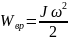
Работа вращающего момента равна произведению момента на угол поворота.
![]()
Мощность при вращательном движении тела равна произведению вращающего момента (момента пары) на угловую скорость.
![]()
Причиной вращательного движения является приложенный к телу вращающий момент относительно оси, который создается парой сил или силой F и определяется по формуле
![]()
Законы сохранения момента импульса и кинетической энергии замкнутой системы тел.
![]()
Используя вторую форму уравнения динамики вращательного движения твердого тела относительно неподвижной оси (производная момента импульса твердого тела относительно оси равна моменту сил относительно той же оси), можно показать, что имеет место векторное равенство
![]()
В
замкнутой системе момент внешних сил
![]() откуда
откуда
![]()
Это выражение представляет собой закон сохранения момента импульса: момент импульса замкнутой системы сохраняется, т. е. не изменяется с течением времени.
Закон сохранения момента импульса — фундаментальный закон природы. Он связан со свойством симметрии пространства — его изотропностью, т. е. с инвариантностью физических законов относительно выбора направления осей координат системы отсчета (относительно поворота замкнутой системы в пространстве на любой угол).
Закон сохранения энергии см. в вопросе 10.
Атомно-молекулярная теория строения вещества, принципы мкт. Уравнение состояния термодинамической системы, параметр состояния (p, V, t), физический смысл t.
Молекулярная физика — раздел физики, изучающий строение и свойства вещества исходя из молекулярно-кинетических представлений, основывающихся на том, что все тела состоят из молекул, находящихся в непрерывном хаотическом движении.
Молекулярная физика основана на 4-х принципах МКТ:
Все вещества состоят из молекул, молекулы – из атомов.
Молекулы находятся в состоянии непрерывного хаотического движения.
Между молекулами действуют силы притяжения и отталкивания.
Между молекулами происходит обмен импульсами и энергией (кинетической и потенциальной)
-
Агрегатное состояние вещества
Кинетическая и потенциальная энергия
Силы взаимодействия между молекулами
Газообразное
Wk » Wp
Малы (молекулы постоянно движутся)
Жидкое
Wk ≈ Wp
Средние (молекулы движутся поступательно, вращательно, колебательно)
Твёрдое
Wk « Wp
Великие (колебательное движение молекул)
Термодинамика — раздел физики, изучающий общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями.
Термодинамическая система — совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и с другими телами (внешней средой).
Состояние системы задается термодинамическими параметрами (параметрами состояния) — совокупностью физических величин, характеризующих свойства термодинамической системы. Обычно в качестве параметров состояния выбирают температуру, давление и удельный объем.
Характеристика вещества в молекулярной физике – уравнение состояния.
f(p, v, t)
Температура (по Кельвину) – мера средней кинетической энергии поступательного движения молекул идеального газа. Температура — физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы.
Давле́ние (P) — физическая величина, равная силе F, действующей на единицу площади поверхности S перпендикулярно этой поверхности.
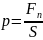
Удельный объем v — это объем единицы массы. Когда тело однородно, т. е. его плотность = const, то v=V/m=1/p.
Пло́тность — скалярная физическая величина, определяемая как отношение массы тела к занимаемому этим телом объёму.
![]()
Изопроцессы, адиобадный процесс.(+19)
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным.
Изохорный процесс (V = const). При изохорном процессе газ не совершает работы над внешними телами:
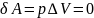
Вся теплота, сообщаемая газу, идёт на увеличение его внутренней энергии:
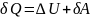
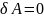
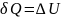
Для произвольной массы газа получим:
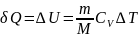
1
p



3
2
Диаграмма этого процесса – изохора,1-2 – изохорное нагревание, 2-3 – охлаждение.
V
Изобарный процесс (p = const). Диаграмма этого процесса (изобара) в координатах p, V изображается прямой, параллельной оси V. Работа газа:

Или
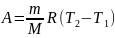
При сообщении газу количества теплоты
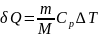
Его внутренняя энергия возрастает на величину
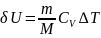
Изотермический процесс (T = const) описывается законом Бойля-Мариотта:
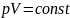
Работа изотермического расширения газа:
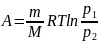
Внутренняя
энергия не меняется:

Кол-во теплоты:
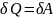
С
p
ледовательно, чтобы при расширении газа температура не понижалась, к газу в течение изотермического процесса необходимо подводить количество теплоты, эквивалентное внешней работе расширения.

Диаграмма процесса (изотерма)
представляет собой гиперболу,
расположенную на диаграмме тем
выше, чем выше температура.
V
Адиобатическим называют процесс, при котором отсутствует теплообмен между системой и окружающей средой.

Внешняя работа совершается за счёт изменения внутренней энергии системы
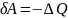
Уравнение адиобатического процесса (уравнение Пуассона)
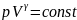
Коэффициент Пуассона:
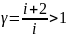
Диаграмма адиобатического процесса (адиобата) изображена гиперболой
А
адиобата
p
 диобата
более крута, чем
диобата
более крута, чем
изотерма, так как при адиобатическом
сжатии 1-3 увеличение давления газа
обусловлено не только уменьшением
его объёма, как при изотермическом
сжатии, но и повышением
температуры.
изотерма
V
