
- •Вопрос 12
- •Вопрос13
- •Вопрос14.
- •X. Кристаллизация растворов.
- •XI. Кипение растворов.
- •Вопрос15
- •Вопрос16 фазовые равновесия
- •Основные понятия и определения
- •Правило фаз для однокомпонентной системы
- •Вопрос17.
- •Вопрос18.
- •Вопрос19.
- •2.1 Скорость химической реакции
- •Вопрос 20. Порядок химической реакции
- •[Править]Реакция нулевого порядка
- •[Править]Реакция первого порядка
- •[Править]Реакция второго порядка
- •[Править]Молекулярность реакции
- •Вопрос21.
- •Вопрос22.
- •6.1.5. Энергия активации
- •Вопрос23
- •Вопрос 24.
- •Вопрос 25.
- •Вопрос28.
- •Вопрос33.
- •Вопрос32. Электродные потенциалы
- •Потенциометрическое титрование
- •Вопрос33. Таким образом, для осуществления электрохимической реакции необходима некоторая система - электрохимическая цепь (рис. 2). Существенные элементы такой системы:
Вопрос18.
Двойные
системы. Состояние
двойной системы определяется тремя
независимыми параметрами - Т, р и
содержанием х одного из компонентов,
поэтому диаграмма состояния такой
системы трехмерна. Обычно принимают
постоянными Т или р и рассматривают
соответствующие плоские сечения
диаграммы состояния, называемые
соотв. изотермич.
(р — х)или изобарными (Т — х)диаграммами
состояния. В конденсир. системах
роль давления сравнительно
невелика и в качестве параметров
состояния обычно
выбирают Т и состав (концентрацию одного
из компонентов).
Д
и а г р а м м ы п л а в к о с т и. Такие
диаграммы состояния служат для
установления условий равновесиямежду
твердыми и жидкими фазами. Рассмотрим
их осн. типы. Простейший вариант
соответствует случаю, когда компоненты
А и В образуют одну жидкую фазу (расплав или
р-р), при охлаждении к-рой только выделяются
(кристаллизуются) индивидуальные в-ва
(не образуются ни твердые р-ры, ни хим.
соед.).
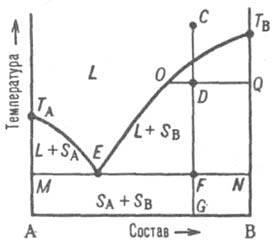 Рис.
2. Диаграмма
плавкости двойной
системы, компоненты к-рой А и В не образуют
твердых р-ров. L - область
существования жидкости (расплава),
(L + SA)
и (L + SB)
области сосуществования жидкой фазы и
твердых А и В соотв.; (SA +
SB)
область существования мех. смеси твердых
А и В. ТАETВ и
MEN - линии ликвидуса и солидуса соотв.,
E-эвтектич. точка. С, D, F, G, О и Q фигуративные
точки (пояснения в тексте).
Рис.
2. Диаграмма
плавкости двойной
системы, компоненты к-рой А и В не образуют
твердых р-ров. L - область
существования жидкости (расплава),
(L + SA)
и (L + SB)
области сосуществования жидкой фазы и
твердых А и В соотв.; (SA +
SB)
область существования мех. смеси твердых
А и В. ТАETВ и
MEN - линии ликвидуса и солидуса соотв.,
E-эвтектич. точка. С, D, F, G, О и Q фигуративные
точки (пояснения в тексте).
На
диаграмме состояния (рис. 2) линия,
изображающая зависимость от
состава т-ры начала выделения из жидкой
фазы твердого компонента (начала
равновесной кристаллизации),
наз. линией ликвидуса. Она состоит из
двух ветвей ТАЕ
и ТВЕ,
отграничивающих фазовое поле жидкости L
от полей сосуществования жидкой фазы
с твердыми А и В соотв. (поля L + SA и
L + SB).
Линия, изображающая зависимость от
состава т-ры окончания
равновесной кристаллизации при
охлаждении (или начала плавления при
нагр.), наз. линией солидуса. Ниже нее
расположено фазовое поле SA +
SB твердого
состояния системы, отвечающее условиям
сосуществования двух твердых
фаз. Происходящие
в системе фазовые изменения описываются
след. образом. При охлаждении жидкой
фазы, напр., из начального состояния С,
фигуративная точка системы в целом
движется вниз вдоль прямой CG. В точке
ее пересечения с линией ликвидуса
начинается кристаллизация компонента
В, система становится двухфазной и
дивариантной или, поскольку давление фиксировано,
условно моновариантной. По
мере кристаллизации В жидкость обогащается
компонентом А, ее состав изменяется по
ветви ликвидуса и по достижении системой
состояния, изображаемого, напр.,
фигуративной точкой D, жидкой и твердой
фазам соответствуют фигуративные точки
О и Q. Прямые, соединяющие фигуративные
точки двух находящихся вравновесии фаз,
наз. нодами (или коннодами); горизонтальные
ноды, подобные OQ, можно провести через
любые точки фазовых полей, отвечающих
гетерог. состояниям системы. При выражении
состава в массовых (молярных) долях
отношение отрезков OD и DQ пропорционально
отношению масс (чисел молей)
твердой и жидкой фаз (т. наз. правило
рычага). Оно позволяет рассчитать по
диаграмме состояния относительные
кол-ва фаз при любой т-ре, чтобы, напр.,
определить полноту кристаллизации или
степень извлечения данного компонента
из жидкой фазы в твердую. В
точке F пересечения прямой CG с линией
солидуса начинаетсякристаллизация компонента
А. Система становится трехфазной
(жидкость и
две твердые фазы А и В) и моновариантной
(условно нонвариантной), т.е. при
постоянном давлении совместная кристаллизация двух
твердых фаз (т. наз. эвтектич. кристаллизация)
протекает при постоянных т-ре и составе
жидкой фазы, отвечающих координатам
эвтектич. точки Е. После завершения
эвтектич. кристаллизации система
состоит из двух твердых фаз и является
дивариантной (условно моновариантной).
В обсуждаемом случае система после
затвердевания состоит из относительно
крупных кристаллов В
и мелкодисперсной смеси совместно
возникших при эвтектич. кристаллизации кристаллов А
и В; такую смесь наз. эвтектикой.
Если исходная жидкость имела
эвтектич. состав, продукт ее затвердевания
- мелкодисперсная эвтектика без
примеси крупных кристаллов к.-л.
из компонентов. При нагр. смеси твердых
А и В описанные явления протекают в
обратной последовательности: изотермич.
образование жидкости эвтектич.
состава вплоть до исчерпания к.-л. из
твердых компонентов
и растворение в жидкости оставшегося
твердого компонента при дальнейшем
повышении т-ры, к-рое завершается по
достижении фигуративной точкой системы
линии ликвидуса. Второй
тип диаграммы характерен для случая
ограниченной р-римости компонентов в
твердом состоянии. Твердый р-р В в А
(обозначается -раствор)
образуется лишь до определенной концентрации В,
твердый р-р А в В (-раствор)
- лишь до определенной концентрации А.
Для таких систем возможны два случая
трехфазногоравновесия:
1) эвтектич. равновесие жидкого расплава состава
Е, твердого р-ра , концентрация к-рого
соответствует точке М, и твердого
р-ра , концентрация к-рого
соответствует точке N, при эвтектич.
т-ре, к-рая, как правило, ниже
т-р плавления TA и
ТB обоих
компонентов (рис. 3).
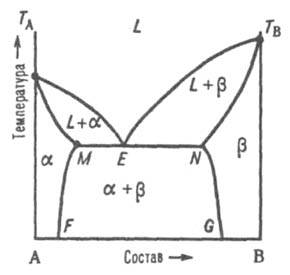 Рис.
3. Диаграмма
плавкости двойной
системы эвтектич. типа с ограниченными
твердыми р-рами. L, и -
области существования жидкой фазы
(расплав)
и твердых р-ров В в А и А в В соотв.; (L + )
и (L + )
- области сосуществования жидкой фазы
и твердых р-ров и соотв.;
( + )
- область сосуществования двух твердых
р-ров. ТАЕТВ и
MEN - линии ликвидуса и солидуса соотв.,
E - эвтектич. точка.
Рис.
3. Диаграмма
плавкости двойной
системы эвтектич. типа с ограниченными
твердыми р-рами. L, и -
области существования жидкой фазы
(расплав)
и твердых р-ров В в А и А в В соотв.; (L + )
и (L + )
- области сосуществования жидкой фазы
и твердых р-ров и соотв.;
( + )
- область сосуществования двух твердых
р-ров. ТАЕТВ и
MEN - линии ликвидуса и солидуса соотв.,
E - эвтектич. точка.
При
охлаждении затвердевшей смеси ниже
линии солидуса MN происходит
изменение концентраций твердых
р-ров и соотв.
по линиям MF и NG, к-рые дают температурную
зависимость растворимости в
твердом состоянии В в А и А в В.
2) Равновесие при
т-ре Тр,
к-рая является промежуточной между
т-рами плавления ТАи
ТB.
Если, напр., т-ра начала кристаллизации расплава с
высоким содержанием А выше ТА (рис.
4), а с высоким содержанием В - ниже ТB,
линия ликвидуса состоит из двух ветвей
ТАР
и ТВР,
соответствующихкристаллизации твердых
р-ров и .
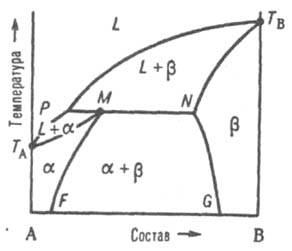 Рис.
4. Диаграмма
плавкости двойной
системы перитектич. типа. Р - перитектич.
точка, остальные обозначения те же, что
и на рис. 3.
Рис.
4. Диаграмма
плавкости двойной
системы перитектич. типа. Р - перитектич.
точка, остальные обозначения те же, что
и на рис. 3.
Эти
ветви пересекаются в т. наз. перитектич.
точке Р - фигуративной точке жидкой
фазы, к-рая может равновесно сосуществовать
одновременно с двумя твердыми р-рами и ,
составы к-рых определяются точками М и
N. Линия солидуса состоит из трех ветвей:
ТAМ,
MN и NTB.
При охлаждении двухфазной системы (L
+ )
до перитектич. т-ры Тр в
системе появляется третья фаза - р-р .
При протекании перитектич. превращения
(фазовой р-ции) жидкость (расплав)
+ твердый р-р твердый
р-р система
моновариантна, или условно нонвариантна,
т. е. при данном давлении равновесие возможно
лишь при постоянных т-ре и составах
каждой из фаз. Если после окончания
перитектич. р-ции остается избыток
жидкой фазы, система переходит в
двухфазное поле (L + ).
При дальнейшем охлаждении
происходит кристаллизация твердого -раствора.
Послед. понижение т-ры (ниже линии
МF) приводит
к тому, что однородный твердый -раствор
становится неустойчивым и, распадаясь,
выделяет нек-рое кол-во р-раствора,
состав к-рого отвечает линии NG. Если
после окончания перитектич. р-ции
полностью исчезает жидкая фаза, система
переходит в двухфазное поле + ;
по мере снижения т-ры составы -
и -растворов
изменяются в соответствии с ходом линий
MF и NG. Возможны
и др. трехфазные равновесия,
напр., при наличии у одного из компонентов
полиморфных модификаций, когда все три
сосуществующие фазы являются твердыми.
Полиморфная модификация может
участвовать в т. наз. эвтектоидном
превращении + или
в перитектоидном превращении + ,
в принципе аналогичных рассмотренным
выше эвтектич. и перитектич. превращениям.
При метатектическом превращении
модификация при
охлаждении распадается на твердую и
жидкую фазы: +
L. Третий
тип диаграммы описывает состояния
двойной системы, компоненты к-рой А и В
образуют устойчивое хим. соед., к-рое не
разлагается вплоть до т-ры плавления и
переходит в жидкую фазу того же состава,
т. е. плавится конгруэнтно.
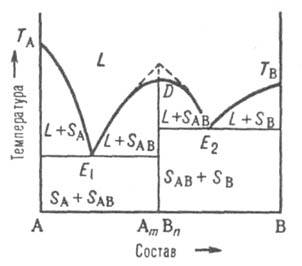 Рис.
5. Диаграмма
плавкости двойной
системы, компоненты к-рой А и В образуют
конгруэнтно плавящееся хим. соед. АmВn.
D - сингулярный максимум, Е1 и
Е2 -
эвтектич. точки; остальные обозначения
те же, что и на рис. 3 и 4.
Рис.
5. Диаграмма
плавкости двойной
системы, компоненты к-рой А и В образуют
конгруэнтно плавящееся хим. соед. АmВn.
D - сингулярный максимум, Е1 и
Е2 -
эвтектич. точки; остальные обозначения
те же, что и на рис. 3 и 4.
В
точке плавления,
соответствующей стехиометрич. составу
АmВn,
на линии ликвидуса имеется сингулярный
максимум (рис. 5); это значит, что линия
D - АmВn разделяет
систему на две подсистемы. На диаграмме
максимуму отвечает излом (показан
пунктиром на рис. 5). В каждой из подсистем
взаимод. между компонентами, соотв. А и
АmВn,
В и АmВn,
может быть представлено диаграммами
эвтектич. или перитектич. (или любого
другого) типа. Если соед. AmBn частично
диссоциировано в жидкой фазе, максимум
на кривой ликвидуса несколько сглажен
в соответствии со степенью
диссоциации.
Если соед. АmВn диссоциирует
и в твердом состоянии, то сглаженный
максимум будет и на линии солидуса.
Однако независимо от вида максимума,
общий характер фазового
равновесия в
системе определяется характером взаимод.
соед. АmВn с
компонентами А и В.
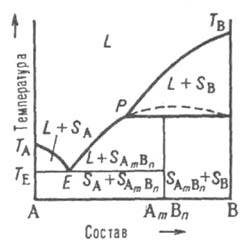 Рис.
6. Диаграмма
плавкости двойной
системы, компоненты к-рой А и В образуют
инконгруэнтно плавящееся хим. соед.
АmВn,
обозначения те же. что и на рис. 4 и 5.
Рис.
6. Диаграмма
плавкости двойной
системы, компоненты к-рой А и В образуют
инконгруэнтно плавящееся хим. соед.
АmВn,
обозначения те же. что и на рис. 4 и 5.
Четвертый
тип диаграмм. Компоненты А и В образуют
хим. соед., разлагающееся ниже
т-ры плавления (т.
наз. инконгруэнтное плавление).
Напр., при охлаждении жидкости (расплава)
до нек-рой т-ры Тр (рис.
6) кристаллизуется только компонент В;
при Тр происходит
перитектич. р-ция с образованием хим.
соед. АmВn в
твердом состоянии, т. е. р-ция твердая
фаза SВ + расплав перитектич.
состава твердая
фаза SА(m)В(n).
Если при этом в твердой фазе компонент
В имеется в избытке, в результате перитектич.
р-ции исчезает жидкая фаза и при дальнейшем
охлаждении ниже Тр остается
смесь двух твердых фаз SB и
SА(m)B(n).
Если же в твердой фазе компонента В
недостает, в результате р-ции
исчезают кристаллы В
и жидкость при
дальнейшем охлаждении выделяет кристаллы соед.
АmВn,
изменяя свой состав по линии ликвидуса
РЕ. При т-ре ТЕпроисходит
эвтектич. кристаллизация AmBn и
А. Возможны и др. варианты диаграммы.
Описанные типыдиаграмм
плавкости могут
усложняться из-за полиморфизма как
компонентов А и В, так и соед. АmВn.
Диаграммы
растворимости. При
отсутствии в системе твердых фаз
диаграмма состояния состоит из области
существования одной жидкой фазы (т. наз.
области гомогенности) и области
сосуществования двух насыщенных жидких
р-ров разного состава, образующих
несмешивающиеся друг с другом слои
(рис. 7). Кривая, разделяющая эти области,
наз. бинодалью. Так, при т-ре
Т1 в равновесии находятся
р-р компонента В в А (его состав отвечает
точке С) и р-р А в В (его состав отвечает
точке D). Если однородный р-р 1 охладить
до т-ры Т1,
он распадется на две жидкие фазы.
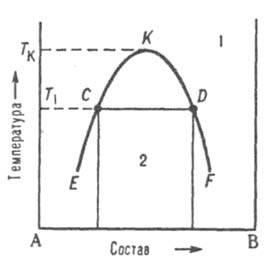 Рис.
7 Диаграмма
растворимости двойной
системы, компоненты к-рой А и В ограниченно
растворимы друг в друге; 1 область
существования однородного р-ра, 2 область
сосуществования двух насыщенных р-ров;
ECKDF - бинодаль, CD - нода, К -верхняя критич.
точка растворимости.
Рис.
7 Диаграмма
растворимости двойной
системы, компоненты к-рой А и В ограниченно
растворимы друг в друге; 1 область
существования однородного р-ра, 2 область
сосуществования двух насыщенных р-ров;
ECKDF - бинодаль, CD - нода, К -верхняя критич.
точка растворимости.
Обычно
при повышении т-ры
взаимная растворимость жидкостей увеличивается,
поэтому по своим св-вам оба насыщенных
р-ра, составы к-рых изменяются по отрезкам
бинодали ЕК и KF, сближаются. Наконец,
при т-ре Tк различие
между ними исчезает; эта т-ра наз.
критической т-рой растворимости (смешения),
выше нее может существовать лишь одна
жидкая фаза. Большинство систем с
расслоением р-ров характеризуются
только одной критич. т-рой р-римости,
чаще всего верхней, т. е. на диаграмме
состояния имеют незамкнутую снизу
бинодаль. Если в таких системах не
образуются хим. соед., область
сосуществования двух жидких фаз
ограничена снизу кривой кристаллизации одного
из компонентов при т-ре превращения
жидкая фаза 1 жидкая
фаза 2 + твердая фаза. Такое
трехфазное равновесие наз.
монотектическим; оно по своей термодинамич.
природе аналогично эвтектическому или
эвтектоидному. При синтектическом
трехфазномравновесии две
жидкие фазы взаимодействуют с образованием
твердого соед. Такое равновесие аналогично
перитектическому. В
нек-рых системах бинодаль имеет форму
замкнутой кривой (овал), т. е. система
имеет две т-ры смешения верхнюю
и нижнюю. Диаграмма равновесия жидкость-пар.
При р = const каждому составужидкой
смеси отвечает
определенная т-ра равновесия с паром и
определенный состав пара,
отличающийся, как правило, от состава жидкой
смеси.
На диаграмме состояния (рис. 8, а)
кривые кипения и конденсацииизображают
зависимости т-р начала кипения и конденсации от
состава и отделяют поля жидкости L
и пара V
от поля (L + V)гетерог. состояний жидкость-пар.
На кривой кипения м.
б. экстремум: максимум (рис. 8, б) или
минимум (рис. 8, в); в этих точках
кривая кипения касается
кривой конденсации,
т. е. составы равновесныхжидкости и пара совпадают Жидкие
смеси такого
состава полностью выкипают, подобно
чистым жидкостям,
при постоянной т-ре без изменения состава
(см. Азеотропные
смеси).
Диаграммы состояния,
описывающиеравновесия двухкомпонентных
твердых р-ров с жидкими р-рами и жидких
р-ров с паром,
подобны.
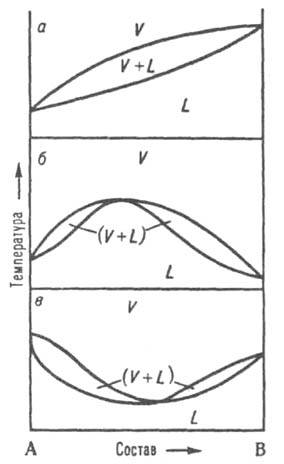 Рис.
8. Диаграммы состояния, двойной системы,
описывающие равновесие жидкость - пар.
L и V области существования жидкости и пара соотв..
(L + V) область сосуществования жидкой и
паровой фаз; а система без азеотропной
точки; б и в два типа азеотропных
смесей.
Рис.
8. Диаграммы состояния, двойной системы,
описывающие равновесие жидкость - пар.
L и V области существования жидкости и пара соотв..
(L + V) область сосуществования жидкой и
паровой фаз; а система без азеотропной
точки; б и в два типа азеотропных
смесей.
