
- •Строение вещества:
- •3) Адиабатный процесс, процесс, происходящий в физической системе без теплообмена с окружающей средой.
- •Энтропия по Больцману
- •Строение вещества элементарные частицы
- •4) Типы радиоактивных распадов
- •6) Термоядерная реакция— разновидность ядерной реакции, при которой лёгкие атомные ядра объединяются в более тяжёлые ядра.
- •7 ) Бета-распад нейтрона — спонтанное превращение свободного нейтрона в протон с излучением β-частицы (электрона) и электронного антинейтрино.
- •8) Методы наблюдения и регистрации элементарных частиц
- •21) Уравнение Шредингера для частицы вблизи потенциального барьера прямоугольной формы.
- •С тационарные уравнения Шредингера имеют вид:
- •25) Спин — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого.
21) Уравнение Шредингера для частицы вблизи потенциального барьера прямоугольной формы.
С тационарные уравнения Шредингера имеют вид:
где
![]() ,
,
![]() –
волновые вектора,
–
волновые вектора,
![]() –
постоянная Планка. Решение волнового
уравнения при
–
постоянная Планка. Решение волнового
уравнения при
![]() ищем
в виде суммы падающей и отражённой
волны
ищем
в виде суммы падающей и отражённой
волны
![]() ,
а решение при
,
а решение при
![]() –
в виде прошедшей волны
–
в виде прошедшей волны
![]() .
решение в области потенциального
барьера
.
решение в области потенциального
барьера
![]() есть
есть
![]() .
Постоянные коэффициенты a,
b,
c,
d
определяются из условия непрерывности
волновой функции
.
Постоянные коэффициенты a,
b,
c,
d
определяются из условия непрерывности
волновой функции![]() и
и![]() в точках
в точках
![]() и
и
![]() .
.
В качестве коэффициента прозрачности барьера D естественно взять отношение плотности потока вероятности прошедших частиц к плотности потока вероятности частиц, падающих на барьер. В рассматриваемом случае, это отношение будет просто равно квадрату модуля волновой функции, оказавшейся за барьером, так как амплитуда падающей волны принята за единицу, а волновые вектора падающей и прошедшей волны совпадают.
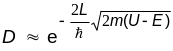
Как видно из полученного соотношения, вероятность прохождения тем больше, чем уже барьер (меньше L) и чем он ниже (меньше разность U - E).
2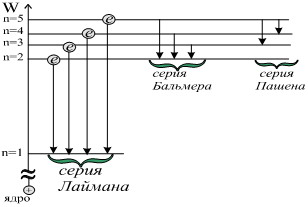 2)
Квантовый гармонический осциллятор
- это колеблющаяся по гармоническому
закону микрочастица, находящаяся в
связанном состоянии внутри атома или
ядра.
2)
Квантовый гармонический осциллятор
- это колеблющаяся по гармоническому
закону микрочастица, находящаяся в
связанном состоянии внутри атома или
ядра.
потенциальная
энергия
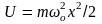 .
.
стационарное уравнение Шредингера
приобретает вид:
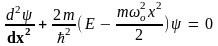 .
.
Спектр собственных значений энергий:
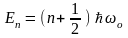
 ,где квантовое
число n
= 0, 1, 2, 3
... . Таким
образом, существует и "нулевая
энергия"
,где квантовое
число n
= 0, 1, 2, 3
... . Таким
образом, существует и "нулевая
энергия"
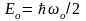
Существование отличной от нуля минимально возможной энергии осциллятора имеет глубокий смысл. Это означает, что колебания микрочастиц не прекращаются никогда, что в свою очередь означает недостижимость абсолютного нуля температуры.
23) Боровская теория атома водорода
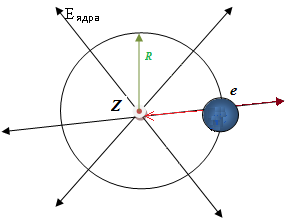 Электроны
притягиваются к ядру за счет
электростатических сил взаимодействия.
Однако электроны не падают на ядро,
поскольку вращаются вокруг него с
определенной скоростью, т.е. имеют
определенную кинетическую энергию.
Электроны
притягиваются к ядру за счет
электростатических сил взаимодействия.
Однако электроны не падают на ядро,
поскольку вращаются вокруг него с
определенной скоростью, т.е. имеют
определенную кинетическую энергию.
Электрон находится на определенном расстоянии от ядра, так как обе силы - центростремительная Fцс, связывающая заряженные частицы, и центробежная Fцб, стремящаяся оторвать электрон от ядра, - уравновешивают друг друга, т.е.
Fцс = Fцб.
Постулаты Бора — основные допущения для объяснения закономерности линейчатого спектра атома водорода и водородоподобных ионов и квантового характера испускания и поглощения света.
Первый постулат Бора (постулат стационарных состояний): электроны в атоме могут обладать лишь определенными (разрешенными) значениями энергии, другими словами-находиться на определенных энергетических уровнях, образующих дискретный энергетический спектр атома.
Второй постулат Бора (правило частот): при определенных условиях электроны могут переходить с одного уровня на другой (или с одной орбиты на другую), поглощая или испуская фотон.Существует орбита с наименьшей возможной энергией, на которой электрон может находиться неограниченно долго
это его основное состояние. При переходе с низшего энергети ческого уровня на высший электрон возбуждается, но при каждом удобном случае всегда стремиться вернуться из возбужденного состояния обратно в основное.
Правило квантования орбит: из всех орбит электрона возможны только те, для которых момент импульса равен целому кратному постоянной Планка
![]()
Уравнение движения электрона по круговой орбите:
![]()
Серия Бальмера — спектральная серия в спектре атома водорода.
Данная серия образуется при переходах электронов с возбужденных энергетических уровней на второй в спектре излучения и со второго уровня на все вышележащие уровни при поглощении.
Ф![]() ормула
Бальмера
ормула
Бальмера
Где n — главное квантовое число — натуральное число, большее или равное 3.
Достоинства теории Бора
1)Объяснила дискретность энергетических состояний водородоподобных атомов.
2)Теория Бора подошла к объяснению внутриатомных процессов с принципиально новых позиций, стала первой полуквантовой теорией атома.
3)Эвристическое значение теории Бора состоит в смелом предположении о существовании стационарных состояний и скачкообразных переходов между ними. Эти положения позднее были распространены и на другие микросистемы.
Недостатки теории Бора
1)Не смогла объяснить интенсивность спектральных линий.
2 )Справедлива
только для водородоподобных атомов и
не работает для атомов, следующих за
ним в таблице
Менделеева.
)Справедлива
только для водородоподобных атомов и
не работает для атомов, следующих за
ним в таблице
Менделеева.
3)Теория Бора логически противоречива: не является ни классической, ни квантовой. В системе двух уравнений, лежащих в её основе, одно — уравнение движения электрона — классическое, другое — уравнение квантования орбит — квантовое.
24) уравнение Шредингера для атома водорода
![]()
Здесь
ψ — волновая
функция
электрона в системе отсчёта протона,
m — масса электрона, где
![]() ,
h — постоянная
Планка,
E — полная энергия электрона,
,
h — постоянная
Планка,
E — полная энергия электрона,
![]() —
оператор
Лапласа.
—
оператор
Лапласа.
И уравнение Шредингера в сферических координатах:
Пространственное квантование -квантование не только вектора, но и его проекции. Оно приводит к «расщеплению» энергетических уровней на ряд подуровней.
Вырождение
энергетических уровней,
существование двух или более стационарных
состояний
квантовой
системы (атома, молекулы) с одинаковыми
значениями энергии. С![]() истема,
полная энергия которой определяется
заданием оператора Я (гамильтониана),
может иметь т
стационарных
состояний, для которых ур-ние Шрёдингера
истема,
полная энергия которой определяется
заданием оператора Я (гамильтониана),
может иметь т
стационарных
состояний, для которых ур-ние Шрёдингера
![]() определяет
соответствующие волновые ф-ции
определяет
соответствующие волновые ф-ции
![]() (i
= 1, 2, ..., т)и
одно значение энергии Е,
одинаковое
для всех т
состояний.
Энергетич. уровень с энергией Е
при
(i
= 1, 2, ..., т)и
одно значение энергии Е,
одинаковое
для всех т
состояний.
Энергетич. уровень с энергией Е
при
![]() наз.
вырожденным, число т
разл.
независимых волновых ф-ций - кратностью
вырождения уровня. О состояниях с
волновыми ф-циями
наз.
вырожденным, число т
разл.
независимых волновых ф-ций - кратностью
вырождения уровня. О состояниях с
волновыми ф-циями
![]() говорят
как о состояниях, вырожденных по энергии,
или вырожденных состояниях. Если одному
значению энергии отвечает одно состояние,
т.е. m=1, уровень наз. невырожденным.
говорят
как о состояниях, вырожденных по энергии,
или вырожденных состояниях. Если одному
значению энергии отвечает одно состояние,
т.е. m=1, уровень наз. невырожденным.

