- •2.1. Предмет термодинаміки і термодинамічний метод.
- •2.2. Основні поняття та визначення.
- •3.1. Термодинамічна система:
- •3.2. Термодинамічні процеси та стани: рівноважні й нерівноважні.
- •4.1. Зміст термодинамічного процесу: теплота і робота
- •5.1. Теплота процесу: поняття теплоємності тіла.
- •5.2. Масова, об'ємна й мольна теплоємності
- •5.3. Закон збереження і перетворення енергії
- •5.4. Внутрішня енергія
- •5.5. Перше начало термодинаміки
- •5.6. Ентальпія.
- •6.1. Термічне рівняння стану
- •6.2. Фізичний зміст теплоємностей.
- •7.1. Ентропія
- •7.2. Теплові діаграми.
- •8.1. Внутрішня енергія, ентальпія й ентропія ідеального газу.
- •8.3. Основні властивості газових сумішей
- •8.5 Парціальні тиски
- •9.1. Термодинамічний метод дослідження процесів
- •Ізохорний процес
- •9.3. Ізобарний процес
- •9.4. Ізотермічний процес
- •9.5. Адіабатний процес
- •9.6. Політропні процеси
- •9.7. Політропний процес
- •. Другий закон термодинаміки: його значення й сфера застосування
- •10.2. Формулювання другого начала термодинаміки
- •11.1. Умови роботи теплових машин
- •11.2. Кругові термодинамічні процеси, або цикли
- •11.3. Термодинамічний аналіз кругових процесів: баланс теплоти й роботи в теплових машинах
- •11.4. Термічний к. К. Д. І холодильний коефіцієнт циклів
- •12.1. Прямий оборотний цикл Карно та його термічний ккд
- •12.2. Зворотний оборотний цикл Карно та його холодильний коефіцієнт
- •12.3. Перша теорема Карно
- •12.4. Середньоінтегральна температура підведення (відводу) тепла й еквівалентний цикл Карно.
- •12.5. Узагальнений (регенеративний) цикл Карно
- •12.6. Абсолютна термодинамічна температура
- •13.1. Властивості оборотних і необоротних циклів та математичне вираження другого закону термодинаміки
- •13.2. Зміни ентропії в оборотних і необоротних процесах
- •13.3. Принцип зростання ентропії та фізичний зміст другого закону термодинаміки
- •13.4. Ентропія та статистичний характер другого закону термодинаміки
- •13.5. Третій закон термодинаміки (теорема Нернста)
- •14.1. Максимальна робота й функції стану.
- •14.2. Термодинамічні потенціали.
- •Графічне представлення співвідношень характеристичних функцій
- •Канонічі рівняння стану
- •14.4. Рівняння Гіббса-Гельмгольца
- •14.5. Хімічний потенціал і нерівність Гіббса
- •14.6. Загальні умови рівноваги термодинамічної системи
- •15.1. Властивості реальних газів
- •15.2. Рівняння стану Ван-дер-Ваальса
- •15.3. Аналіз рівняння Ван-дер-Ваальса - закон відповідних станів
- •Фазові переходи й фазові діаграми речовин; рівняння Клапейрона - Клаузіуса
- •16.2. Рівняння Клапейрона - Клаузіуса
- •Одержання пари та її характерні стани
- •Основні параметри станів водяної пари.
7.1. Ентропія
Як уже вказувалося, теплота q не є функцією стану, і dq = du + pdv не буде повним диференціалом; dq являє собою тільки деяку нескінченно малу величину. Для того щоб проінтегрувати праву частину рівняння першого закону термодинаміки dq= du + pdv, повинна бути відома залежність р від v (або р від Т). У математиці доводиться, що диференційний двочлен завжди можна перетворити в повний диференціал шляхом ділення (або множення) на інтегруючий дільник. Таким інтегруючим дільником для елементарної кількості теплоти dq є абсолютна температура Тº К.
Покажемо це на прикладі ідеального газу. Маємо dq = cv dT + pdv, або, замінивши р на RT/v, получимо dq = cv dT + RTdv/v.
Розділивши обидві частини останнього рівняння на Т, знаходимо
dq/T
=cv
dT/T
+ Rdv/v,
(
6-38)
Звідси вираження dq/T при оборотній зміні стану газу є повний диференціал деякої функції змінних Т и v (сv залежить тільки від температури, а R — величина постійна). Клаузиус назвав цю функцію ентропією й позначив буквою S. Виміряється повна ентропія S у джоулях на градус (дж/град), а питома ентропія s — у джоулях на кілограм на градус (дж/( кг-град)).
Таким чином, диференціал ентропії для оборотної зміни стану визначається як
ds
= dq/T, (
6-39)
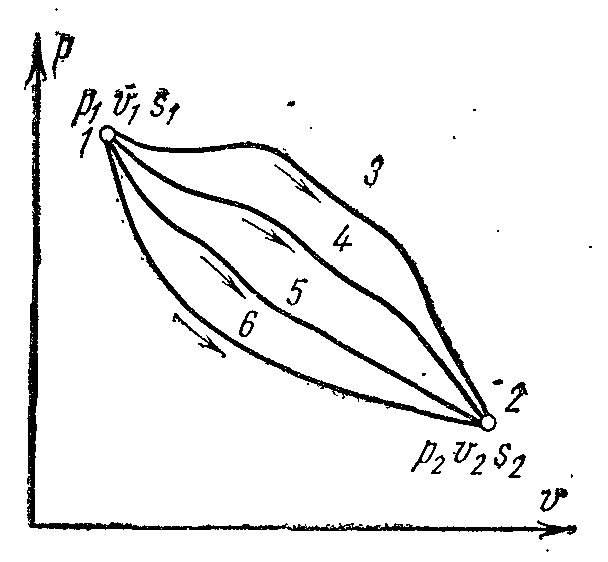
Ентропія є однозначна функція стану газу, що приймає для кожного його стану цілком певне значення. Ентропія є екстенсивним (залежить від маси ре-
|
човини)
параметром стану й зміна її в будь-якому
термодинамічному процесі повністю
визначається крайніми станами тіла
й не залежить від шляху процесу. У
зв'язку із цим ентропія газу, будучи
параметром стану, у процесах 1-3-2,
1-4-2, 1-5-2, 1-6-2 (мал.
6-
|
Оскільки ентропія має властивість адитивності, то алгебраїчна сума змін ентропії окремих тіл, що складають термодинамічну систему, буде дорівнювати зміні ентропії всієї термодинамічної системи в цілому. Причому зміни ентропії окремих тіл залежно від процесу можуть бути як позитивними, так і негативними величинами.
Ентропія може бути визначена як функція основних параметрів стану:
![]()
Повні диференціали ентропії мають вигляд:
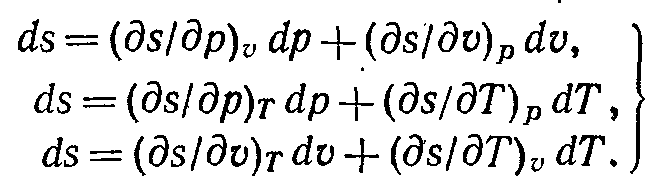 (6-40)
(6-40)
Частинні похідні ентропії, що входять у ці рівняння, обчислюються за рівняннями, які виведені в гл. X.
Для
одержання зміни ентропії як функції
Т і
v
співвідношення
(6-38)
представимо в наступному виді:
![]()
(6-41)
Інтегруючи, при сv = const знайдемо для ідеального газу
![]()
(6-42)
Для
одержання зміни ентропії як функції Т
і р
слід з рівняння (6-41)
виключити v.
З рівняння Клапейрона після диференціювання
одержимо:
![]()
Підставляючи
значення
dv/v
у рівняння
(6-41),
маємо
![]()
Інтегруючи при cp = const, знаходимо
![]()
(6-43)
Для
одержання зміни ентропії як функції
р
і
v
треба з
рівняння
(6-41)
виключити Т.
Користуючись тим же методом, одержимо
![]()
звідки
![]()
Інтегруючи, визначаємо
![]() (6-44)
(6-44)
З огляду
на те, що зміна ентропії тіла не залежить
від характеру процесу, отримані рівняння
(6-42),
(6-43)
і (6-44)
застосовні як для оборотних, так і для
необоротних процесів.
З рівняння
(6-39)
можна одержати загальну формулу для
визначення теплоємності.
Теплоємність сх будь-якого процесу дорівнює добутку абсолютної температури Т на частинну похідну ентропії s по температурі Т при х = const:
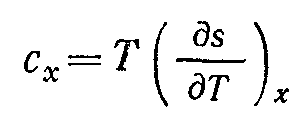 ( 6-45)
( 6-45)
Підставивши в рівняння (5-9) і (5-13) значення dq з рівняння (6-39), одержимо
![]() (6-46)
(6-46)
![]() (6-47)
(6-47)
Рівності (6-46) і (6-47) містять тільки параметри стану і їхні диференціали й носять назву термодинамічних тотожностей; вони відносяться до оборотних процесів.
Якщо в термодинамічній системі крім роботи зміни об'єму відбувається робота dlv, не пов'язана зі зміною об'єму тіла, то термодинамічні тотожності мають вигляд
![]() (
6-48)
(
6-48)
![]() (
6-49)
(
6-49)
У термодинаміку внутрішня енергія, ентальпія, ентропія, теплоємності називаються калоричними властивостями речовини, а питомий об'єм, абсолютний тиск, температура — термічними властивостями.