
- •2.1. Предмет термодинаміки і термодинамічний метод.
- •2.2. Основні поняття та визначення.
- •3.1. Термодинамічна система:
- •3.2. Термодинамічні процеси та стани: рівноважні й нерівноважні.
- •4.1. Зміст термодинамічного процесу: теплота і робота
- •5.1. Теплота процесу: поняття теплоємності тіла.
- •5.2. Масова, об'ємна й мольна теплоємності
- •5.3. Закон збереження і перетворення енергії
- •5.4. Внутрішня енергія
- •5.5. Перше начало термодинаміки
- •5.6. Ентальпія.
- •6.1. Термічне рівняння стану
- •6.2. Фізичний зміст теплоємностей.
- •7.1. Ентропія
- •7.2. Теплові діаграми.
- •8.1. Внутрішня енергія, ентальпія й ентропія ідеального газу.
- •8.3. Основні властивості газових сумішей
- •8.5 Парціальні тиски
- •9.1. Термодинамічний метод дослідження процесів
- •Ізохорний процес
- •9.3. Ізобарний процес
- •9.4. Ізотермічний процес
- •9.5. Адіабатний процес
- •9.6. Політропні процеси
- •9.7. Політропний процес
- •. Другий закон термодинаміки: його значення й сфера застосування
- •10.2. Формулювання другого начала термодинаміки
- •11.1. Умови роботи теплових машин
- •11.2. Кругові термодинамічні процеси, або цикли
- •11.3. Термодинамічний аналіз кругових процесів: баланс теплоти й роботи в теплових машинах
- •11.4. Термічний к. К. Д. І холодильний коефіцієнт циклів
- •12.1. Прямий оборотний цикл Карно та його термічний ккд
- •12.2. Зворотний оборотний цикл Карно та його холодильний коефіцієнт
- •12.3. Перша теорема Карно
- •12.4. Середньоінтегральна температура підведення (відводу) тепла й еквівалентний цикл Карно.
- •12.5. Узагальнений (регенеративний) цикл Карно
- •12.6. Абсолютна термодинамічна температура
- •13.1. Властивості оборотних і необоротних циклів та математичне вираження другого закону термодинаміки
- •13.2. Зміни ентропії в оборотних і необоротних процесах
- •13.3. Принцип зростання ентропії та фізичний зміст другого закону термодинаміки
- •13.4. Ентропія та статистичний характер другого закону термодинаміки
- •13.5. Третій закон термодинаміки (теорема Нернста)
- •14.1. Максимальна робота й функції стану.
- •14.2. Термодинамічні потенціали.
- •Графічне представлення співвідношень характеристичних функцій
- •Канонічі рівняння стану
- •14.4. Рівняння Гіббса-Гельмгольца
- •14.5. Хімічний потенціал і нерівність Гіббса
- •14.6. Загальні умови рівноваги термодинамічної системи
- •15.1. Властивості реальних газів
- •15.2. Рівняння стану Ван-дер-Ваальса
- •15.3. Аналіз рівняння Ван-дер-Ваальса - закон відповідних станів
- •Фазові переходи й фазові діаграми речовин; рівняння Клапейрона - Клаузіуса
- •16.2. Рівняння Клапейрона - Клаузіуса
- •Одержання пари та її характерні стани
- •Основні параметри станів водяної пари.
9.3. Ізобарний процес
При ізобарному процесі виконується умова dp = 0 або р = const.
Такий термодинамічний процес може протікати в циліндрі, поршень якого переміщається без тертя так, що тиск у циліндрі дорівнює постійному тиску навколишнього середовища, що діє на поршень іззовні (мал. 7-4, а).
Рівняння ізобарного процесу може бути отримане з рівняння стану ідеального газу при р = const. У цьому випадку
![]() (
7-5)
(
7-5)
Таким чином, при ізобарному процесі (постійному тиску) об'єм тієй самої кількості газу завжди пропорційний абсолютній температурі.
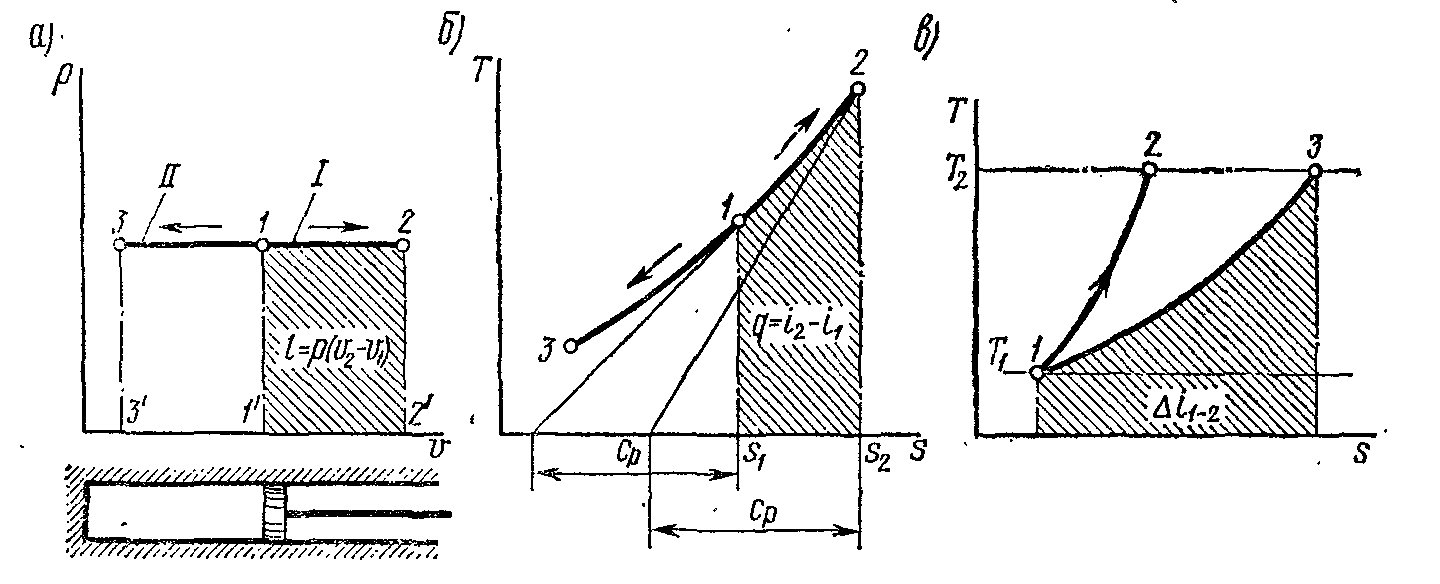
Рис. 7-4, а – в
На мал. 7-4, а зображений графік процесу. Крива процесу називається ізобарою.
Це співвідношення називається законом Гей-Люссака.
При розширенні газу його температура зростає, при стисненні - зменшується.
Питома робота зміни об'єму при цьому виражається наступним рівнянням:
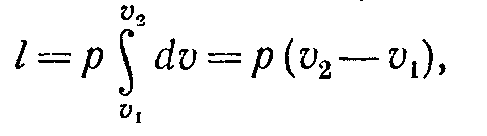 ( 7-6)
( 7-6)
або з
урахуванням того, що p
v1
=
RT1,
і
pv2
= RT2,
![]() , (
7-6')
, (
7-6')
тобто робота газу при ізобарному процесі позитивна тільки в тому випадку, якщо температура газу збільшується.
Корисна зовнішня робота при цьому (робота, що є у розпорядженні)
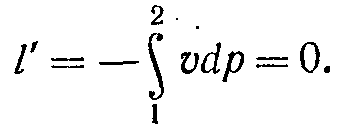
На vp-діаграмі робота газу зображується у вигляді пл. 11'22' під процесом 1-2 (рис. 7-4, а), причому l > 0, якщо v2 > v1.
Поклавши у формулі ( 7-6') T2 - T1 = 1º, знайдемо l = R. Отже, питома газова постійна - це робота 1 кг газу в ізобарному процесі при збільшенні температури на 1º.
При відомому значенні істинної питомої теплоємності ізобарного процесу сp питома теплота q, що підводиться до робочого тіла (або що відводиться), при dp = 0 визначається рівнянням
![]()
звідки
![]()
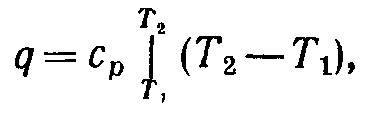
де сp |T2T1 — середня ізобарна теплоємність в інтервалі температур від T1 до Т2.
Якщо сp = const, то
![]() (
7-7)
(
7-7)
Із цього співвідношення видно, що теплота, підведена до робочого тіла в ізобарному процесі, йде на збільшення його ентальпії.
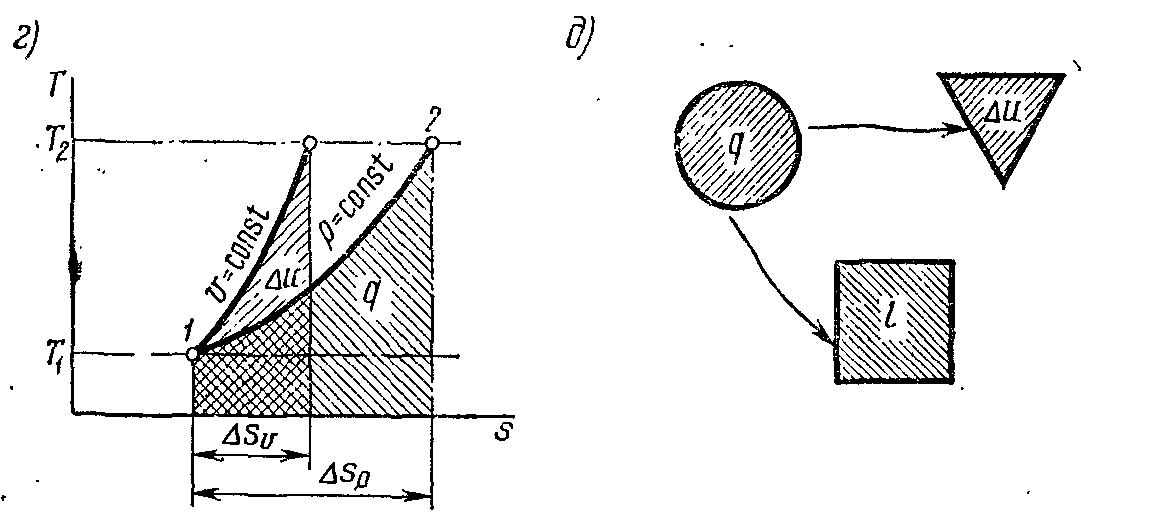
Рис. 7-4, г – д
При ізобарному процесі міняється температура робочого тіла отже, і його внутрішня енергія.
Тому на здійснення зовнішньої роботи витрачається лише частина наданої тілу ззовні теплоти qp, 1-2 , яка дорівнює р(v2 – v1), а інша частина йде на збільшення внутрішньої енергії тіла. Перетворення енергії при ізобарному розширенні газу ілюструється схемою на мал. 7-4, д
Для визначення частки теплоти, затрачуваної в ізобарному процесі на зовнішню роботу, треба всі члени рівняння першого закону термодинаміки розділити на dq:
1 = du/dq + dl/dq,
звідки з урахуванням співвідношення k = γ = cp/cv
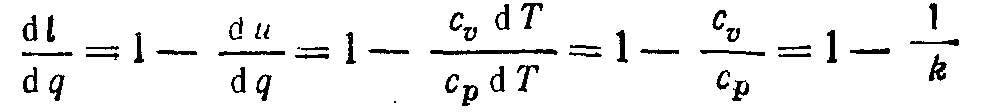
и
d u/dq = 1/k.
Якщо прийняти k = 1,4, що відповідає двохатомним газам, то
dl/dq = 0,285 і du/dq = 0,715.
Отже, 28,5% всієї підведеної до робочого тіла теплоти в ізобарному процесі двохатомного газу витрачається на здійснення зовнішньої роботи, а 71,5% - на зміну внутрішньої енергії.
Для оборотного ізобарного процесу при постійній теплоємності зміна ентропії знаходиться з рівняння ( 6-43):
![]()
але при р = const ln p2/p1 = 0, тому
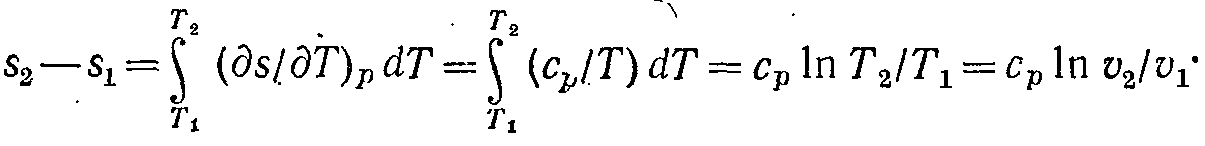 ( 7-8)
( 7-8)
Таким чином, ізобара на sТ-діаграмі є деякою логарифмічною кривою (див. рис. 7-4,б) і, подібно ізохорі, звернена опуклістю долілиць.
Якщо Т2 > T1 то відповідно до вираження (7-8) ∆sp = s2 – s1 > 0, тобто ізобарний процес на sТ-діаграмі (рис. 7-4, б) протікає так, що при збільшенні ентропії збільшується й температура. Якщо провести міркування, аналогічні таким щодо ізохорного процесу (мал.7-2, б), то неважко довести, що піддотична до кривої ізобарного процесу дорівнює сp.
Оскільки сp > cv, то ізобарний процес на sТ-діаграмі протікає більш полого, ніж ізохорний процес того ж газу (риc. 7-4, г).
Всі ізобари є еквідистантними кривими, що мають при одній і тій же температурі однакові кутові коефіцієнти. Горизонтальна відстань між ізобарами різних тисків визначається по рівнянню ( 6-43) при Т = const (див. мал. 7-3):
![]()
З останнього рівняння слідує, що відстань між ізобарами залежить від величини тисків і природи газу. Чим більше тиск газу, тим ізобара ближче до осі ординат.
Із зіставлення рівнянь (7-3) і (7-8) слідує, що у випадку здійснення ізохорного й ізобарного процесів в одному інтервалі температур зростання ентропії буде більше в ізобарному процесі, тому що cр завжди більше cv.
З мал. 7-4, б з урахуванням рівняння ( 7-7) слідує, що площа під ізобарним процесом чисельно дорівнює зміні ентальпії. Оскільки зміна ентальпії робочого тіла визначається зміною тільки його температури, то в будь-яких термодинамічних процесах, що протікають у тому самому інтервалі температур, ентальпія змінюється на те саме значення. Тому площа під ізобарним процесом на sТ-діаграмі в інтервалі температур Т2 – T1 дає зміну ентальпії у будь-якому іншому термодинамічному процесі, що протікає в цьому ж інтервалі температур. Отже, для визначення зміни ентальпії в довільному процесі 1-2 (рис. 7-4, в) необхідно цей процес зобразити в sТ-діаграмі, визначити T2 і T1, вибрати в цьому інтервалі будь-який ізобарний процес (наприклад, 1 - 3) і тоді площа під процесом 1-3, заштрихована на мал. 7-4,в, дасть зміну ентальпії у процесі 1-2.
Оскільки при ізобарному розширенні газу Т2 > Т1, то ∆i 1-2 > 0.
