
- •28) Пены, классификация и строение, разрушение пен и практическое применение.
- •29) Эффект Марангони.
- •30) Тиксотропия.
- •31) Флотация.
- •32) Эмульсии. Обращение фаз, разрушение эмульсий и практическое применение.
- •38) Слои Шиллера.
- •39) Тактоиды.
- •40) Биконтинуальные дисперсные системы.
- •41) Кольца и слои Лизеганга.
- •42) Пептизация.
- •43) Флокуляция.
- •44) Гетерокоагуляция.
- •45) Адагуляция.
- •46) Аддитивность коагуляции.
- •47) Антагонизм коагуляции.
- •48) Синергизм коагуляции.
- •49) Коагуляционные структуры.
- •50) Структуры с фазовыми контактами.
- •51) Синерезис.
45) Адагуляция.
Адагуляция – подвид коагуляции, адгезионное взаимодействие частиц дисперсной фазы с макроповерхностями. Приводит к укрупнению частиц в результате потери агрегативной устойчивости. (Адгезионная природа подразумевает взаимодействие за счет межмолекулярных сил и является результатом стремления системы к минимуму поверхностной свободной энергии).
??Равновесие описывается факторами агрегативной устойчивости (электростатический, адсорбционно-сольватный, энтропийный).
46) Аддитивность коагуляции.
В соответствии с теорий ДЛФО введение электролита в дисперсную систему вызывает сжатие ДЭС на поверхности частиц, вследствие чего они могут подойти к друг к другу на расстояния, на которых преобладают силы притяжения. Уменьшение толщины ДЭС сопровождается обменом противоионов этого слоя на вызывающие коагуляцию ионы электролита. При коагуляции золя смесью двух электролитов можно наблюдать три отдельных случая: аддитивность, антагонизм и синергизм коагуляции. Аддитивное действие электролитов. Этот случай характеризуется прямой, соединяющей значения порогов коагуляции каждым электролитом. (по осям отложены значения концентраций электролитов). Электролиты действуют как бы независимо друг от друга. Аддитивность обычно наблюдается при сходстве коагулирующей способности обоих электролитов (т.е. когда они содержат противоионы одинаковой валентности).
 ,
где С1 и С2- концентрации, γ- пороги для
электролита 1 и 2 (кол-во молей).
,
где С1 и С2- концентрации, γ- пороги для
электролита 1 и 2 (кол-во молей).
47) Антагонизм коагуляции.
Явление антагонизма электролитов можно наблюдать при коагуляции золей смесями некоторых электролитов. Для объяснения антагонистического действия электролитов при коагуляции предложен ряд теорий. Фрейндлих считал, что причиной антагонизма является способность одного иона понижать адсорбционную способность и коагулирующую силу другого иона. Согласно Свену Одену, Гошу и Дхару, антагонизм ионов объясняется тем, что при введении смеси электролитов ионы какого-нибудь одного вида, адсорбируясь на одноименно заряженных частицах, могут повысить их ξ- потенциал, устойчивость системы. Согласно теории Глазманова антагонизм ионов дл я сильно заряженных золей есть следствие электростатических взаимодействий в диффузных атмосферах коллоидных частиц, а для слабо заряженных золей обуславливается конкуренцией ионов за места в адсорбционном слое. Так же была предложена теория, которая учитывает адсорбционные явления и позволяет найти критические концентрации смеси по критическим потенциалам и определить способность к адсорбции отдельных компонентов. Основное положение: учет соотношения электростатической и ванн - дер - ваальсовой компонент энергии взаимодействия частиц. На коагулирующее действие смеси электролитов может влиять химическое взаимодействие между их ионами, ведущее к образованию не обладающих коагулирующим действием комплексов или нерастворимых соединений(коагуляция золя AgI смесью электролитов K2SO4 и Th(NO3)4, образующих комплекс K2(TH(SO4)3), в котором теряет свою коагулирующую способность).
48) Синергизм коагуляции.
 Явление
синегризма можно наблюдать при коагуляции
золей смесями некоторых электролитов.
Явление имеет практическое значение,
так как даже при добавлении к коллоидной
системе одного коагулятора благодаря
содержанию в системе стабилизирующего
электролита коагуляция проходит в
действительности под влиянием, по
крайней мере, двух электролитов.
Явление
синегризма можно наблюдать при коагуляции
золей смесями некоторых электролитов.
Явление имеет практическое значение,
так как даже при добавлении к коллоидной
системе одного коагулятора благодаря
содержанию в системе стабилизирующего
электролита коагуляция проходит в
действительности под влиянием, по
крайней мере, двух электролитов.
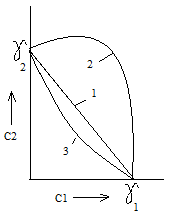
При коагуляции золя смесью двух электролитов можно наблюдать три предельных случая.
Аддитивное действие электролитов (кривая 1)
Антагонизм электролитов (кривая 2)
Синергизм электролитов (кривая 3) . Электролиты как бы способствуют друг другу, и для коагуляции их требуется меньше, чем это нужно по правилу аддитивности. Явление синергизма (сенсибилизации) – коагулирующее действие одного электролита усиливается при прибавлении второго.
Условия, при которых наблюдается синергизм, трудно сформулировать.
Пример, смесь LiCl и CaCl2 в их действии на гидрозоль сернистой кислоты.
