
- •Вопрос 50.
- •Вопрос 49
- •Методы защиты металла от коррозии можно разделить на несколько групп:
- •Современная защита металлов от коррозии базируется на следующих методах:
- •Широко применяются следующие основные решения защиты металлических конструкций от коррозии:
- •Вопрос 45
- •Вопрос 44 Электролиз водных растворов электролитов
- •Вопрос 43
- •Электролиз расплавов солей
- •Вопрос 40
- •Вопрос 39
- •Простейший гальванический элемент,элемент вольта.
- •Вопрос 38
- •Вопрос 2
- •Вопрос 3
- •Количество энтальпии
- •Вопрос 7 Зависимость скорости химич.Реакций от температуры
- •Вопрос 8
- •Вопрос9
- •Вопрос 10
Вопрос9
Гомогенный катализ.
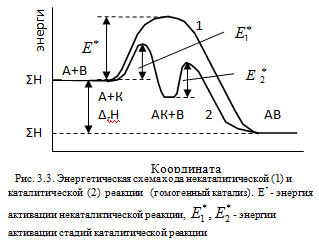
Механизм действия катализаторов основан на теории промежуточных соединений (Н.Д.Зелинский, П.Сабатье). Согласно этой теории катализатор образует с реагирующими веществами промежуточные соединения. Энергия активации этого процесса меньше, чем энергия активации некаталитической реакции, что и ведет к увеличению скорости превращения.
Пусть имеются две реакции, протекающие с невысокой скоростью: A + B = AВ, CD = C + D. В присутствии катализатора К реакции протекают в две стадии: А + К = АК, CD + K = CDK, где АК и CDK являются промежуточными соединениями, образующими конечные продукты: АК + В = АВ + К , CDK = C + D + K. Гомогенными каталитическими реакциями являются ферментативные процессы, протекающие в живых организмах. Энергетическая схема реакции A + B = AB приведена на рис.3.3. Из рис.3.3 следует: 1) энергии активации каждой из промежуточных стадий меньше энергии активации некаталитической реакции Е*; 2) использование катализатора не изменяет энтальпию реакции ΔrH.
Гетерогенный катализ.

Исходной стадией гетерогенного катализа является адсорбция реагентов, т.е. связывание молекул реагирующих веществ с поверхностью другого вещества. Процесс адсорбции происходит в несколько стадий. Благодаря диффузии, молекулы реагирующих веществ подходят к поверхности, где происходит их адсорбция. Взаимодействие адсорбированных частиц реагентов с поверхностью катализатора ведет к увеличению их энергии. Процесс называется активированной адсорбцией, который протекает не на всей поверхности катализатора, а только на активных центрах (различные дефекты поверхности). Число активных центров определяет активность катализатора и зависит от способа приготовления катализатора и величины его поверхности. В результате активированной адсорбции изменяется электронная структура молекул реагентов, что ведет к снижению энергии активации и на поверхности катализатора протекает химическая реакция. Продукт химической реакции покидает поверхность катализатора, т.е. происходит десорбция и за счет диффузии переходит в окружающую среду.
Все три стадии – адсорбция, образование активированного комплекса и десорбция являются активационными процессами и характеризуются собственными энергиями активации. Скорость каталитической реакции возрастает, если энергии активации каждой из этих стадий будет ниже энергии активации соответствующей некаталитической реакции (рис.3.4).
Вопрос 10
Цепные
реакции активные
центры - свободные атомы и
радикалы, способные легко, с малойэнергией
активации реагировать
с исходными молекулами, порождая наряду
с молекулой продукта также новый активный
центр. В разветвленныххимических Цепные
реакции в
качестве активных центров могут выступать
также возбуждённые молекулы, а в т. н.
вырожденно-разветвлённых реакциях (см.
ниже) - также нестабильные молекулы
промежуточных веществ.
Неразветвлённые Цепные
реакции Химические процессы
с неразветвлёнными цепями можно
рассмотреть на примере фотохимической
реакции между водородом и хлором. В
этой Цепные
реакции молекула хлора, поглощая
квант света, распадается на два атома. Каждый
из образовавшихся атомов хлора начинает
цепь химических превращений;
в этой цепи атомы хлора и водорода выступают
в качестве активных частиц. Длина цепи
может быть очень большой - число
повторяющихся элементарных реакций
продолжения цепи на один зародившийся
активный центр может достигать десятков
и сотен тысяч. Обрыв цепей происходит
в результате рекомбинации атомов в
объёме реактора, захвата атомов его
стенкой с последующей рекомбинацией
на стенке, образования неактивного
радикала при реакции активных центров
с молекулами всегда присутствующих
примесей [например, при реакции
между атомарным водородом и
молекулами кислорода (примесями)
с образованием радикалаHO2;
этот радикал в условиях не очень высоких
температур не реагирует с исходными
молекулами].
Реакцию между H2 и Cl2,
вызванную действием кванта света hn, можно
представить схемой:
![]() -
зарождение цепи
-
зарождение цепи
![]() -
продолжение цепи
-
продолжение цепи
 -
обрыв цепи
В последних двух стадиях М - любая третья
частица (атом или
молекула), которая нужна для того, чтобы
отнять часть энергии у образующихся
частиц Cl2 и HO2 и
тем самым сделать невозможным их обратный
распад.
Скорость Цепные
реакции чрезвычайно
чувствительна к скоростям зарождения
и обрыва и поэтому зависит от
наличия химических примесей,
от материала и состояния стенок
реакционного сосуда, а также от его
размера и формы.
Скорость реакций с неразветвлёнными
цепями (W)
равна<
W = w0n = w0 Wп /Woбр
где w0 - скорость
зарождения цепей, n - длина цепей, Wп и Woбр -
соответственно скорости продолжения
и обрыва цепей (Woбр может
быть составной величиной, отражающей
различные пути обрыва цепи).
По неразветвлённо-цепному механизму
протекает большое число практически
важных реакций, в частности хлорирование, ряд
реакций жидкофазного окисления органических
соединений, термический крекинг. Своеобразным
процессом с неразветвлёнными цепями
является такжеполимеризация, при
которой цепь реакций одновременно
определяет и длину полимерной молекулы.
Образование активных частиц, необходимых
для зарождения цепей, происходит при
разрыве одной из связей в молекуле и
всегда сопряжено с затратой энергии.
Свободные радикалы можно получать за
счёт внешних источников энергии, например
кванта света, поглощаемого молекулой
при фотохимической реакции, а также
энергии электронов, образующихся в
электрическом разряде или воздействии
a-, b- и g-излучения. Наиболее важно в
практическом отношении образование
свободных радикалов за счёт внутренней
тепловой энергии системы. Но энергия
связи в большинстве молекул велика и,
значительно велика энергия их прямой
диссоциации на радикалы, поэтому путём
непосредственного распада исходных
молекул Цепные
реакции инициируются
лишь при более или менее высоких
температурах. Часто, однако, зарождение
цепей происходит при участии различных
примесей-инициаторов. Такими примесями
могут быть молекулы со слабой связью,
при распаде которых легко образуются
радикалы, начинающие цепи, или молекулы,
легко вступающие в окислительно-восстановительные
реакции, например Fe2+ + H2O2 ®Fe3+ + OH- + OH.
Инициирование может происходить также
на стенке реакционного сосуда. Энергия
активации при этом понижается благодаря
тому, что в системе используется энергия
адсорбции одного из радикалов. Цепи
могут зарождаться и в результате реакций
между молекулами. Некоторые из таких
реакций протекают достаточно быстро
даже при невысоких температурах,
например F2 + C2H4 ® F + C2H4F.
Концепция неразветвлённых Цепные
реакции возникла
в результате работ немецкого учёного
М. Боденштейна, обнаружившего (1913), что
в ряде фотохимических реакций один
поглощённый квант света вызывает
превращение многих молекул. В частности,
при образовании HCl из H2 иCl2 в
среднем на каждый поглощённый квант
образуется до 1 000 000 молекул HCl.
Поскольку один квант может активировать
только одну молекулу, остальные вступают
в реакцию без непосредственного
воздействия света. Механизм этой реакции
предложил В. Нернст (1916).
Современная теория реакций с
неразветвлёнными цепями была создана
и развита школой Боденштейна, а также
трудами советских учёных.
Реакции
с разветвленными цепями. Совершенно
особыми свойствами обладают реакции,
в которых цепи разветвляются. Эти реакции
были обнаружены в 1926-28 группой ленинградских
физиков на примере окисления
паров фосфора. Было
установлено, что при малом изменении
какого-либо параметра реакционной
системы (концентрации реагентов,
температуры, размера сосуда, примесей
специфических веществ) и даже при
разбавлении инертным газом практически
незаметная реакция скачкообразно
переходит в быстрый, самоускоряющийся
процесс типасамовоспламенения. Это
явление имеет место даже при низких
температурах, когда скорость зарождения
подобных процессов чрезвычайно мала,
а также в условиях, когда тепловой взрыв
невозможен. Поэтому вне области
воспламенения (см. рис.)
реакция практически не идёт. Н.
Н.Семёновым с
сотрудниками впервые было дано объяснение
этого парадоксального факта и создана
количественная теория разветвленныхЦепные
реакции Значительный
вклад в развитие представлений о
разветвленных Цепные
реакции внесли
также пионерские работы С. Н.Хиншелвуда с
сотрудниками по изучению верхнего
предела воспламенения. За исследования
механизма химических реакций
Семёнову и Хиншелвуду была присуждена
в 1956 Нобелевская премия.
В ходе разветвленных Цепные
реакции при
взаимодействии одного из активных
центров возникает более чем один (часто
- три) новый активный центр, т. е. происходит
размножение цепей.
Примером разветвленной Цепные
реакции может
служить окисление водорода, где
разветвление и продолжение цепей
происходит по схеме:
(1)
Н + O2 ® OH +
О - разветвление
-
обрыв цепи
В последних двух стадиях М - любая третья
частица (атом или
молекула), которая нужна для того, чтобы
отнять часть энергии у образующихся
частиц Cl2 и HO2 и
тем самым сделать невозможным их обратный
распад.
Скорость Цепные
реакции чрезвычайно
чувствительна к скоростям зарождения
и обрыва и поэтому зависит от
наличия химических примесей,
от материала и состояния стенок
реакционного сосуда, а также от его
размера и формы.
Скорость реакций с неразветвлёнными
цепями (W)
равна<
W = w0n = w0 Wп /Woбр
где w0 - скорость
зарождения цепей, n - длина цепей, Wп и Woбр -
соответственно скорости продолжения
и обрыва цепей (Woбр может
быть составной величиной, отражающей
различные пути обрыва цепи).
По неразветвлённо-цепному механизму
протекает большое число практически
важных реакций, в частности хлорирование, ряд
реакций жидкофазного окисления органических
соединений, термический крекинг. Своеобразным
процессом с неразветвлёнными цепями
является такжеполимеризация, при
которой цепь реакций одновременно
определяет и длину полимерной молекулы.
Образование активных частиц, необходимых
для зарождения цепей, происходит при
разрыве одной из связей в молекуле и
всегда сопряжено с затратой энергии.
Свободные радикалы можно получать за
счёт внешних источников энергии, например
кванта света, поглощаемого молекулой
при фотохимической реакции, а также
энергии электронов, образующихся в
электрическом разряде или воздействии
a-, b- и g-излучения. Наиболее важно в
практическом отношении образование
свободных радикалов за счёт внутренней
тепловой энергии системы. Но энергия
связи в большинстве молекул велика и,
значительно велика энергия их прямой
диссоциации на радикалы, поэтому путём
непосредственного распада исходных
молекул Цепные
реакции инициируются
лишь при более или менее высоких
температурах. Часто, однако, зарождение
цепей происходит при участии различных
примесей-инициаторов. Такими примесями
могут быть молекулы со слабой связью,
при распаде которых легко образуются
радикалы, начинающие цепи, или молекулы,
легко вступающие в окислительно-восстановительные
реакции, например Fe2+ + H2O2 ®Fe3+ + OH- + OH.
Инициирование может происходить также
на стенке реакционного сосуда. Энергия
активации при этом понижается благодаря
тому, что в системе используется энергия
адсорбции одного из радикалов. Цепи
могут зарождаться и в результате реакций
между молекулами. Некоторые из таких
реакций протекают достаточно быстро
даже при невысоких температурах,
например F2 + C2H4 ® F + C2H4F.
Концепция неразветвлённых Цепные
реакции возникла
в результате работ немецкого учёного
М. Боденштейна, обнаружившего (1913), что
в ряде фотохимических реакций один
поглощённый квант света вызывает
превращение многих молекул. В частности,
при образовании HCl из H2 иCl2 в
среднем на каждый поглощённый квант
образуется до 1 000 000 молекул HCl.
Поскольку один квант может активировать
только одну молекулу, остальные вступают
в реакцию без непосредственного
воздействия света. Механизм этой реакции
предложил В. Нернст (1916).
Современная теория реакций с
неразветвлёнными цепями была создана
и развита школой Боденштейна, а также
трудами советских учёных.
Реакции
с разветвленными цепями. Совершенно
особыми свойствами обладают реакции,
в которых цепи разветвляются. Эти реакции
были обнаружены в 1926-28 группой ленинградских
физиков на примере окисления
паров фосфора. Было
установлено, что при малом изменении
какого-либо параметра реакционной
системы (концентрации реагентов,
температуры, размера сосуда, примесей
специфических веществ) и даже при
разбавлении инертным газом практически
незаметная реакция скачкообразно
переходит в быстрый, самоускоряющийся
процесс типасамовоспламенения. Это
явление имеет место даже при низких
температурах, когда скорость зарождения
подобных процессов чрезвычайно мала,
а также в условиях, когда тепловой взрыв
невозможен. Поэтому вне области
воспламенения (см. рис.)
реакция практически не идёт. Н.
Н.Семёновым с
сотрудниками впервые было дано объяснение
этого парадоксального факта и создана
количественная теория разветвленныхЦепные
реакции Значительный
вклад в развитие представлений о
разветвленных Цепные
реакции внесли
также пионерские работы С. Н.Хиншелвуда с
сотрудниками по изучению верхнего
предела воспламенения. За исследования
механизма химических реакций
Семёнову и Хиншелвуду была присуждена
в 1956 Нобелевская премия.
В ходе разветвленных Цепные
реакции при
взаимодействии одного из активных
центров возникает более чем один (часто
- три) новый активный центр, т. е. происходит
размножение цепей.
Примером разветвленной Цепные
реакции может
служить окисление водорода, где
разветвление и продолжение цепей
происходит по схеме:
(1)
Н + O2 ® OH +
О - разветвление
 -
продолжение
или
в сумме Н + 3H2 + O2 =
2H2O +
3H.
-
продолжение
или
в сумме Н + 3H2 + O2 =
2H2O +
3H.
Молекулярность
реакции,
число частиц реагентов, взаимодействующих
друг с другом в одной элементарной
(простой) реакции и превращающихся в
продукты. Так, для реакций в растворах
молекулярность реакции не учитывает
число молекул растворителя,
образующих сольватную оболочку или
мол. комплексы с реагентами, так как эти
молекулы не входят в состав продуктов
реакции. В реакциях замещения и
элиминирования органических соединений,
протекающих часто в несколько стадий,
Молекулярность реакции оценивается
как число молекул, претерпевающих
химическое превращение в лимитирующей
стадии. Соответственно числу реагирующих
частиц различаютмономолекулярные
реакции, бимолекулярные
реакции и тримолекулярные
реакции, отличающиеся
кинетическими закономерностями и
механизмом. Как правило, молекулярность
простой реакции совпадает с порядком
реакции,
однако бывают и несовпадения.
Например, рекомбинации атомов
в газовой фазе протекают через тройные
столкновения типа ![]() где
М-третья частица. Суммарный порядок
таких реакций-третий (скорость
u = = k[М][Сl]2,
где k-константа
скорости), но молекулярность равна 2,
так как в химическом взаимодействии
участвуют два атома хлора, а частица М
лишь принимает на себя энергию,
выделившуюся прирекомбинации атомов,
не претерпевая при этом химические
превращения.
где
М-третья частица. Суммарный порядок
таких реакций-третий (скорость
u = = k[М][Сl]2,
где k-константа
скорости), но молекулярность равна 2,
так как в химическом взаимодействии
участвуют два атома хлора, а частица М
лишь принимает на себя энергию,
выделившуюся прирекомбинации атомов,
не претерпевая при этом химические
превращения.
