
- •8) Зависимость скорости реакции от природы реагирующих веществ и температуры (правило Вант-Гоффа, энергия активации).
- •9) Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия.
- •10)Условие химического равновесия. Константа химического равновесия гомогенных и гетерогенных систем.
- •11)Смещение химического равновесия. Принцип Ле-Шателье.
- •12)Современное представление о строении атома и элементарных частицах. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары. Ядерная энергетика.
- •13)Квантово-механическая модель атома. Двойственная природа электрона. Квантовые числа. Атомные электронные орбитали. Принцип Паули. Правило Гунда.
- •14)Строение многоэлектронных атомов. Правила и порядок заполнения атомных орбиталей электронами. Правило Клечковского.
- •15) Периодическая система д. И. Менделеева. Физический смысл периодов и групп. Изменение свойств элементов по периодам и группам.
- •17)Химическая связь по методу валентных связей. Основные характеристики.
- •18)Образование химической связи по методу молекулярных орбиталей (ммо).
- •19)Типы химических связей и типы молекул.
- •20)Виды ковалентной связи. Ионная связь. Примеры и свойства веществ.
- •21)Направленность ковалентной связи (σ и π-связи), гибридизация атомных электронных орбиталей, формы молекул.
- •22)Агрегатное состояние вещества. Свойства аморфных и кристаллических веществ.
- •23)Определение кристаллической решетки, ее свойства.
- •24)Типы кристаллов, их свойства. Понятие о металлической связи.
- •25)Зонная теория строения твердого тела: проводники, полупроводники, изоляторы.
- •26)Дефекты реальных кристаллов. Собственная и примесная проводимость полупроводников.
22)Агрегатное состояние вещества. Свойства аморфных и кристаллических веществ.
Существует три состояния вещества:
ГАЗ(Не имеет постоянного объема, Не имеет собственной формы, Занимает всю предоставленную емкость)
ЖИДКОСТЬ(Сохраняет объем, Легко меняет форму)
ТВЕРДОЕ ТЕЛО (Сохраняет объем, Сохраняет форму)
Аморфные вещества не имеют кристаллической структуры , изотропны, не имеют определённой точки плавления.. Аморфные вещества могут находиться либо в стеклообразном состоянии (при низких температурах), либо в состоянии расплава (при высоких температурах). Вязкость аморфных материалов — непрерывная функция температуры: чем выше температура, тем ниже вязкость аморфного вещества.
Кристаллические веществ.аХарактерные свойства кристаллических веществ: а) однородность строения; б) анизотропия; в) симметричность; г)имеют строго определенную температуру плавления; д) характеризуются правильным расположением частиц, из которых они построены: атомов, молекул или ионов.
23)Определение кристаллической решетки, ее свойства.
Кристаллические решётки веществ-это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки размещения частиц называют узлами кристаллической решётки.
Компактность кристаллической решетки или степень заполненности ее объема атомами является важной характеристикой. Она определяется такими показателями как параметр решетки, число атомов в каждой элементарной ячейке, координационное число и плотность упаковки.
Параметр решетки - это расстояние между атомами по ребру элементарной ячейки.
Плотность упаковки представляет собой отношение суммарного объема, занимаемого собственно атомами в кристаллической решетке, к ее полному объему.
24)Типы кристаллов, их свойства. Понятие о металлической связи.
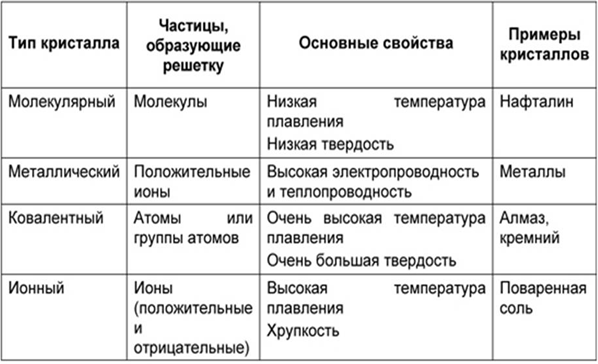
Металлическая связь — химическая связь, обусловленная наличием относительно свободных электронов. Характерна как для чистых металлов, так и их сплавов и интерметаллических соединений.
Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа движутся валентные электроны, отцепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решётка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть. Силы связи не локализованы и не направлены. Поэтому в большинстве случаев проявляются высокие координационные числа.
25)Зонная теория строения твердого тела: проводники, полупроводники, изоляторы.
Зонная теория твёрдого тела — квантовомеханическая теория движения электронов в твёрдом теле.
Зонная структура различных материалов
В различных веществах, а также в различных формах одного и того же вещества, энергетические зоны располагаются по-разному. По взаимному расположению этих зон вещества делят на три большие группы:
проводники — зона проводимости и валентная зона перекрываются, образуя одну зону, называемую зоной проводимости, таким образом, электрон может свободно перемещаться между ними, получив любую допустимо малую энергию. Таким образом, при приложении к твердому телу разности потенциалов, электроны смогут свободно двигаться из точки с меньшим потенциалом в точку с большим, образуя электрический ток. К проводникам относят все металлы.
полупроводники — зоны не перекрываются и расстояние между ними составляет менее 3.5 эВ. Для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется энергия меньшая, чем для диэлектрика, поэтому чистые (собственные, нелегированные) полупроводники слабо пропускают ток.
диэлектрики — зоны не перекрываются и расстояние между ними составляет более 3.5 эВ. Таким образом, для того, чтобы перевести электрон из валентной зоны в зону проводимости требуется значительная энергия, поэтому диэлектрики ток практически не проводят.
