
- •8) Зависимость скорости реакции от природы реагирующих веществ и температуры (правило Вант-Гоффа, энергия активации).
- •9) Обратимые и необратимые химические реакции. Химическое равновесие. Константа равновесия.
- •10)Условие химического равновесия. Константа химического равновесия гомогенных и гетерогенных систем.
- •11)Смещение химического равновесия. Принцип Ле-Шателье.
- •12)Современное представление о строении атома и элементарных частицах. Протонно-нейтронная теория строения атомного ядра. Изотопы, изобары. Ядерная энергетика.
- •13)Квантово-механическая модель атома. Двойственная природа электрона. Квантовые числа. Атомные электронные орбитали. Принцип Паули. Правило Гунда.
- •14)Строение многоэлектронных атомов. Правила и порядок заполнения атомных орбиталей электронами. Правило Клечковского.
- •15) Периодическая система д. И. Менделеева. Физический смысл периодов и групп. Изменение свойств элементов по периодам и группам.
- •17)Химическая связь по методу валентных связей. Основные характеристики.
- •18)Образование химической связи по методу молекулярных орбиталей (ммо).
- •19)Типы химических связей и типы молекул.
- •20)Виды ковалентной связи. Ионная связь. Примеры и свойства веществ.
- •21)Направленность ковалентной связи (σ и π-связи), гибридизация атомных электронных орбиталей, формы молекул.
- •22)Агрегатное состояние вещества. Свойства аморфных и кристаллических веществ.
- •23)Определение кристаллической решетки, ее свойства.
- •24)Типы кристаллов, их свойства. Понятие о металлической связи.
- •25)Зонная теория строения твердого тела: проводники, полупроводники, изоляторы.
- •26)Дефекты реальных кристаллов. Собственная и примесная проводимость полупроводников.
13)Квантово-механическая модель атома. Двойственная природа электрона. Квантовые числа. Атомные электронные орбитали. Принцип Паули. Правило Гунда.
В 1924г. Луи де Бройль
выдвинул предположение, что электрон
характеризуется корпускулярно-волновым
дуализмом. Позднее это было подтверждено
на опытах по дифракции на кристаллах.
Де Бройль предложил уравнение, связывающее
длину волны электрона или любой другой
частицы массой m
и скоростью V:
 .
Волны частиц материи де Бройль называл
материальными волнами.
.
Волны частиц материи де Бройль называл
материальными волнами.
В 1927г. Гейзенберг постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы принципиально невозможно определить с абсолютной точностью. А Шредингер в 1926г. Вывел математическое описание поведения электрона в атоме.
В квантово-механической
модели атома используют вероятностный
подход для характеристики положения
электрона. Вероятность нахождения
описывается волновой функцией
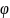 ,
которая характеризует амплитуду волны,
как функцию координат электрона. В
наиболее простом случае эта функция
зависит от трех координат и называется
орбиталью. Орбиталью
называется область пространства, в
котором наиболее вероятно нахождение
электрона.
Так как электрон несет отрицательный
заряд, то его орбиталь представляет
собой определенное распределение
заряда, которое получило название
электронного
облака.
,
которая характеризует амплитуду волны,
как функцию координат электрона. В
наиболее простом случае эта функция
зависит от трех координат и называется
орбиталью. Орбиталью
называется область пространства, в
котором наиболее вероятно нахождение
электрона.
Так как электрон несет отрицательный
заряд, то его орбиталь представляет
собой определенное распределение
заряда, которое получило название
электронного
облака.
Для характеристики поведения электрона в атоме введены квантовые числа: главное, орбитальное, магнитное и спиновое.
Главное квантовое число (n) – характеризует размеры атома и количество энергии на уровне, принимает значения от 1 до 7.
Орбитальное квантовое число(L) – определяет энергию на подуровне и форму электронного облака от 0 до n-1.
Магнитное квантовое число(m) – определяет положение орбитали в пространстве т.е. момент т. е. направление в котором вытянуто электронное облако от –L,0,L.
Спиновое квантовое
число (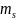 )
– характеризует крутящийся момент,
возникающий при вращении электрона
вокруг оси
)
– характеризует крутящийся момент,
возникающий при вращении электрона
вокруг оси
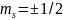 .
.
Принцип Паули: В
атоме не может быть двух электронов, с
одинаковым значением квантовых чисел.
Т.е.
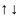 а не
а не
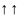 или
или
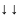 .
.
Правило Гунда:
электроны
заполняются таким образом, что бы спин
был максимальным. Сначала
 ,
потом
,
потом
![]() .
.
14)Строение многоэлектронных атомов. Правила и порядок заполнения атомных орбиталей электронами. Правило Клечковского.
Запись распределения электронов в атоме по оболочкам, подоболочкам и орбиталям, называется электронная конфигурация элемента.
Цифрами обозначают главное квантовое число, буквами подоболочки (s,p,d,f), а степень обозначает число электронов в подоболочки (1s1).
В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание от других электронов, экранирующих их от ядра атома, поэтому последовательность возрастания энергии орбиталей усложняется.
При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии, принцип Паули, правила Гунда и Клечковского.
Принцип min энергии: электроны заполняют орбитали в порядке повышения уровня энергии орбиталей.
Принцип запрета
Паули: в атоме
не может быть двух электронов, обладающих
одинаковым набором квантовых чисел: n,
l, m, ms. Следовательно, на каждой атомной
орбитали может быть не более 2 электронов,
причем они должны иметь противоположные
спины:
![]() .
.
Правило Гунда: электроны заполняются таким образом, что бы спин был максимальным. Сначала , потом .
Правило Клечковского: последовательность заполнения электронами энергетических подуровней происходит в порядке возрастания ∑n+l, а при равной сумме – в порядке возрастания значения главного квантового числа n.
Исключение составляют некоторые атомы, у которых наблюдается отклонение от правила Клечковского (провал электронов): Cu, Ag, Cr, Mo, Pd, Pt и др.
Основной характеристикой атома, определяющей его поведение в химических реакциях, а также свойства простых веществ, является строение внешнего (и частично – предвнешнего) энергетического уровня атома, число неспаренных (валентных) электронов и их энергия относительно ядра атома.
