
- •Растворы полимеров
- •Полимеризация
- •Поликонденсация
- •Полиэтилен
- •Полипропилен
- •Поливинилхлорид
- •Полиэтилентерефталат
- •Полистирол
- •Ионообменные смолы
- •Эпоксидные смолы
- •Волокна химические
- •Пластические массы
- •Гальванический элемент
- •Электродные потенциалы
- •Тривиальные названия
- •Классификация
- •Физические свойства
- •Характерные химические реакции
- •Алкадиены (диеновые углеводороды)
- •Строение, общие свойства
- •Физические свойства
- •Получение
- •Химические свойства
- •Например, 100 г некоторого раствора с плотностью 1,074 г/мл (1074 г/мл) имеет объем 93,1 мл (0,0931 л).
- •36. Окислительно-восстановительные реакции. Важнейшие окислители и восстановители. Типы окислительно-восстановительных реакций.
- •Структура периодической системы
Физические свойства
Бутадиен — газ (tкип -4,5°С), изопрен — жидкость, кипящая при 34°С, диметилбутадиен — жидкость, кипящая при 70°C. Изопрен и другие диеновые углеводороды способны полимеризоваться в каучук. Натуральный каучук в очищенном состоянии является полимером с общей формулой (С5Н8)n и получается из млечного сока некоторых тропических растений. Каучук хорошо растворим в бензоле, бензине, сероуглероде. При низкой температуре становится ломким, при нагревании липким. Для улучшения механических и химических свойств каучука его превращают в резину, подвергая вулканизации. Для получения резиновых изделий сначала их формуют из смеси каучука с серой, а также с наполнителями: сажей, мелом, глиной и некоторыми органическими соединениями, служащими для ycкорения вулканизации. Затем изделия нагревают — горячая вулканизация. При вулканизации сера химически связывается с каучуком. Кроме того, в вулканизированном каучуке сера содержится в свободном состоянии в виде мельчайших частиц.
Получение
Лабораторные методы получения алкадиенов не отличаются от таковых для алкенов (см. выше). Необходимо только иметь в виду, что в реакциях элиминирования при возможности образования сопряженного алкадиена образуется именно он (независимо от действия правила Зайцева!). Однако два представителя алкадиенов — бутадиен-1,3 (дивинил) и 2-метил-бутадиен-1,3 (изопрен) имеют большое практическое значение как мономеры для производства синтетических каучуков, и методы их промышленного получения весьма важны. Рассмотрим их. Бутадиен-1,3 (дивинил) В настоящее время основным способом получения этого вещества является дегидрирование бутана (получаемого из нефти или природного газа) над катализатором, представляющим собой смесь оксидов хрома (III) и алюминия
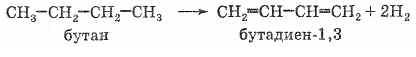 Исторически
имеет огромное значение предложенный
в 1932 году С. В. Лебедевым метод получения
бутадиена из этилового спирта
каталитической реакцией
дегидрирования-дегидратации. Катализатором
этой реакции является смесь на основе
оксидов цинка и алюминия:
Исторически
имеет огромное значение предложенный
в 1932 году С. В. Лебедевым метод получения
бутадиена из этилового спирта
каталитической реакцией
дегидрирования-дегидратации. Катализатором
этой реакции является смесь на основе
оксидов цинка и алюминия:
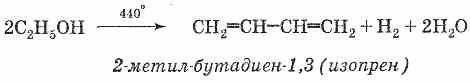 Представляет
собой мономер натурального каучука и
может быть получен из него термическим
разложением без доступа воздуха. В
промышленности получается (аналогично
дивинилу) из легких фракций продуктов
крекинга нефти процессом дегидрирования
на оксидных катализаторах:
Представляет
собой мономер натурального каучука и
может быть получен из него термическим
разложением без доступа воздуха. В
промышленности получается (аналогично
дивинилу) из легких фракций продуктов
крекинга нефти процессом дегидрирования
на оксидных катализаторах:

Химические свойства
1. Реакция электрофильного присоединения(АЕ) более характерна для алкадиенов. Главная особенность химии сопряженных диенов в том, что на первой ступени образуется не только обычный продукт 1,2- присоединения, но и продукт 1,4-присоединения (см. выше).
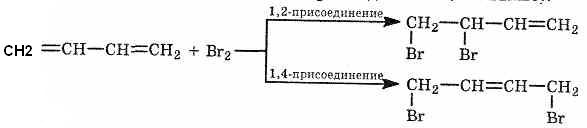 Преимущественное
протекание реакции по тому или иному
пути зависит от конкретных условий. При
избытке брома образуется тетрабромид:
Преимущественное
протекание реакции по тому или иному
пути зависит от конкретных условий. При
избытке брома образуется тетрабромид:
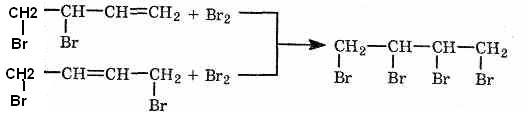 Аналогичным
образом присоединяются хлор,
галогеноводороды, вода (в присутствии
сильных кислот) и некоторые другие
вещества.
2. Полимеризация диеновых
углеводородов (см. Полимеризация).
Полимеризация алкадиенов может
происходить по катионному, радикальному,
координационному, анионному (под
действием натрия) механизмам, приводя
к образованию полимеров, обладающих
высокой эластичностью и напоминающих
природный каучук. Получение синтетического
каучука — основная область применения
диеновых углеводородов (главным образом
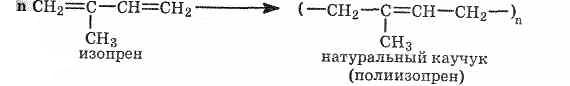
бутадиена и изопрена). Натуральный
каучук — полимер изопрена: n=1000-3000
Аналогичным
образом присоединяются хлор,
галогеноводороды, вода (в присутствии
сильных кислот) и некоторые другие
вещества.
2. Полимеризация диеновых
углеводородов (см. Полимеризация).
Полимеризация алкадиенов может
происходить по катионному, радикальному,
координационному, анионному (под
действием натрия) механизмам, приводя
к образованию полимеров, обладающих
высокой эластичностью и напоминающих
природный каучук. Получение синтетического
каучука — основная область применения
диеновых углеводородов (главным образом
бутадиена и изопрена). Натуральный
каучук — полимер изопрена: n=1000-3000
 Синтетический
каучук в промышленном масштабе впервые
был получен в 1932 г. в нашей стране по
способу С. В. Лебедева:
Синтетический
каучук в промышленном масштабе впервые
был получен в 1932 г. в нашей стране по
способу С. В. Лебедева:
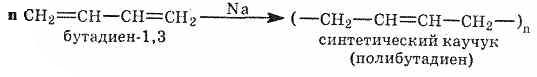 Каучук
имеет громадное значение в народном
хозяйстве. Синтез проходит в две
стадии.
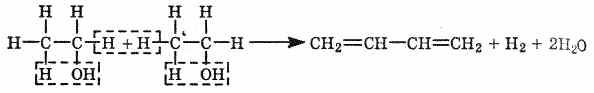
1. Получение бутадиена из
этилового спирта в присутствии
катализатора (Аl2О3, ZnO):
Каучук
имеет громадное значение в народном
хозяйстве. Синтез проходит в две
стадии.
1. Получение бутадиена из
этилового спирта в присутствии
катализатора (Аl2О3, ZnO):
 2.
Полимеризация бутадиена в присутствии
металлического натрия:
2.
Полимеризация бутадиена в присутствии
металлического натрия:
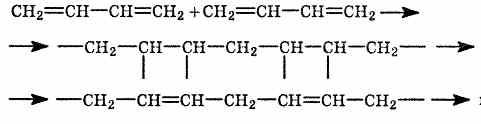 Строение
бутадиенового каучука описывается
формулой (-СН2-СН=СН-СН2-)n
В настоящее
время дивинил получают не только из
спирта. Экономически выгодно оказалось
получение его из бутана, содержащегося
в попутных газах нефтедобычи.
Строение
бутадиенового каучука описывается
формулой (-СН2-СН=СН-СН2-)n
В настоящее
время дивинил получают не только из
спирта. Экономически выгодно оказалось
получение его из бутана, содержащегося
в попутных газах нефтедобычи.
Ацетиле́н — ненасыщенный углеводород C2H2. Имеет тройную связь между атомами углерода, принадлежит к классу алкинов
Химические свойства
Для ацетилена (этина) характерны реакции присоединения:
HC≡CH + Cl2 -> СlСН=СНСl
Ацетилен с водой, в присутствии солей ртути и других катализаторов, образует уксусный альдегид (реакция Кучерова). В силу наличия тройной связи, молекула высокоэнергетична и обладает большой удельной теплотой сгорания — 14000 ккал/м³. При сгорании температура пламени достигает 3300°С. Ацетилен может полимеризироваться в бензол и другие органические соединения (полиацетилен,винилацетилен). Для полимеризации в бензол необходим графит и температура в 400 °C.
Кроме того, атомы водорода ацетилена относительно легко отщепляются в виде протонов, то есть он проявляет кислотные свойства. Так ацетилен вытесняет метан из эфирного раствораметилмагнийбромида (образуется содержащий ацетиленид-ион раствор), образует нерастворимые взрывчатые осадки с солями серебра и одновалентной меди.
Ацетилен обесцвечивает бромную воду и раствор перманганата калия.
Основные химические реакции ацетилена (реакции присоединения, сводная таблица 1.):
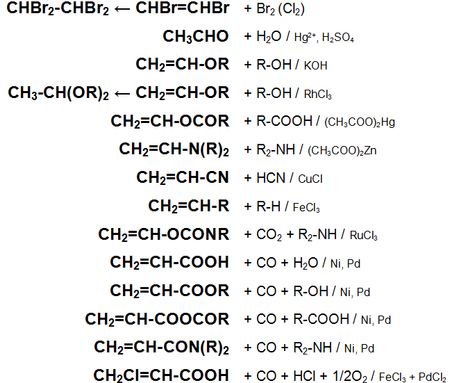
Основные химические реакции ацетилена (реакции присоединения, димеризации, полимеризации, цикломеризации, сводная таблица 2.):
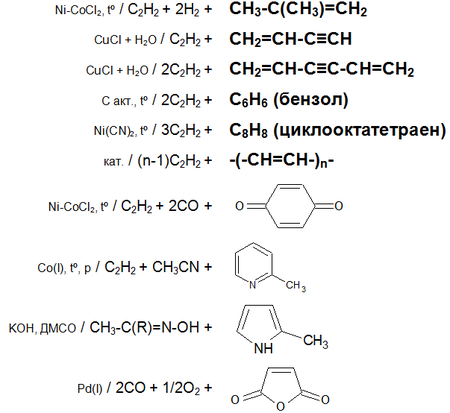
35. Общие свойства растворов.
Общие свойства растворов
Качественный и количественный состав растворов
Раствор - это гомогенная система, состоящая из двух или более веществ, содержание которых можно изменять в определенных пределах без нарушения однородности.
Состав растворов обычно передаётся содержанием в них растворённого вещества в виде массовой доли или молярной концентрации.
Жидкие растворы (в дальнейшем будем называть их просто "растворами") состоят из жидкого растворителя (чаще всего воды) и растворенного вещества, которое до смешения с растворителем могло быть твердым (например KBr), жидким (например H2SO4) или газообразным (например CO2). Состояние веществ в водном растворе обозначается (р), например KBr(р).
Состав растворов обычно передается содержанием в нем растворенного вещества в виде массовой доли или молярной концентрации.
Массовая доля и молярная концентрация растворённого вещества
Массовая доля wВ растворенного вещества В - это отношение его массы mB к массе раствора m(р): wВ = mB / m(р), где m(р) = mB + m(Н2О).
Единица массовой доли вещества в растворе - доля от единицы или от 100%.
Например, если в 100 г раствора находится 1 г KBr, то w(KBr) = 0,01 (1%). Такой раствор называют однопроцентным (1%-ный раствор KBr).
Для приготовления 100 г 1%-ного раствора некоторой соли надо взять 1 г этой соли и 99 г воды. Плотность воды при комнатной температуре принимают равной 1 г/мл, поэтому удобнее отмерять 99 мл воды и добавить 1 г соли.
Молярная концентрация сВ растворённого вещества В - это отношение количества этого вещества nВ к объему раствора V(р): сВ = nВ / V(р). Единица молярной концентрации вещества в растворе: моль/л.
Например, если в 1 л раствора содержится 1 моль KBr, то с(KBr) = 1 моль/л. Такой раствор называют одномолярным и обозначают 1М. Аналогичным образом записи 0,1М; 0,01М и 0,001М означаютдеци-, санти- и миллимолярный раствор.
Для приготовления 1 л 1М раствора KBr необходимо взять навеску соли с количеством вещества 1 моль (то есть 119 г), растворить ее в воде объемом, например, 0,8 л (то есть обязательно меньше 1 л) и затем довести объем раствора до 1 л добавлением воды.
Объем раствора V(р) при данной температуре связан с массой раствора m(р) и его плотностью (ρ) следующим образом: m(р) = ρ · V(р).
