
- •Законы фотоэффекта:
- •Импульс фотона. Давление света.
- •Корпускулярно-волновой дуализм. Волна де Бройля.
- •Соотношение неопределенностей.
- •Волновая функция и ее физический смысл.
- •Свободное движение частицы
- •Основное уравнение мкт
- •Вывод основного уравнения мкт
- •Закон распределения Максвелла по скоростям
- •Барометрическая формула. Распределение Больцмана
- •Закон равномерного распределения энергии по степеням свободы
- •А для идеального газа
- •Адиабатный процесс.
- •Работа при адиабатном процессе
- •Политропный процесс.
- •График политропного процесса
- •Энтропия идеального газа
- •Второе начало термодинамики
- •Цикл Карно и его кпд
- •25. Реальные газы. Уравнение Ван-дер-Вальса.
- •28. Теплоемкость твердых тел
- •29. Испарение, сублимация, плавление и кристаллизация
Волновая функция и ее физический смысл.
Наличие
у частицы волновых свойств приводит к
тому, что в квантовой физике ей
сопоставляется волновая функция
![]() (x,y,z,t).
Физический смысл волновой функции.
Величина
|
(x,y,z,t)|2dV
пропорциональна вероятности того, что
частица будет обнаружена в момент
времени t в объеме dV в окрестности точки
(x,y,z).
Волновая функция
системы невзаимодействующих частиц
(r1,r2,...rn,t)
связана с одночастичными волновыми
функциями
i(ri,t)
соотношением
(x,y,z,t).
Физический смысл волновой функции.
Величина
|
(x,y,z,t)|2dV
пропорциональна вероятности того, что
частица будет обнаружена в момент
времени t в объеме dV в окрестности точки
(x,y,z).
Волновая функция
системы невзаимодействующих частиц
(r1,r2,...rn,t)
связана с одночастичными волновыми
функциями
i(ri,t)
соотношением
(r1,r2,...rn,t) = 1(r1,t)· 2(r2,t)·... n(rn,t).
Свободное движение частицы
Волновая функция свободно движущейся частицы с энергией E и импульсом p имеет вид
(r,t)
= Aexp[i(kr -
![]() t)]
= Aexp[i(pr - Et)/
]
.
t)]
= Aexp[i(pr - Et)/
]
.
Константа A может быть найдена из условия нормировки волновой функции
A = (2 )-3/2.
Т.е. в тех случаях, когда частица находится в области пространства, где действующие на нее силы равны нулю (свободное движение), энергия частицы может принимать любые значения. Энергетический спектр свободно движущейся частицы непрерывный.
Уравнение Шредингера для стационарных состояний
Частица в одномерной прямоугольной яме
Квантовый гармонический осциллятор
Молекулярно-кинетическая теория идеальных газов
Уравнение состояния идеального газа
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
 —
давление,
—
давление,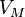 —
молярный
объём,
—
молярный
объём,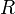 —
универсальная
газовая постоянная
—
универсальная
газовая постоянная —
абсолютная
температура,К.
—
абсолютная
температура,К.
Так как
![]() ,
где
,
где
![]() —
количество
вещества, а
—
количество
вещества, а
![]() ,
где
,
где
![]() —
масса,
—
масса,
![]() —
молярная
масса, уравнение состояния можно
записать:
—
молярная
масса, уравнение состояния можно
записать:
![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
В случае постоянной массы газа уравнение можно записать в виде:
![]()
![]()
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
![]() —
закон
Бойля — Мариотта.
—
закон
Бойля — Мариотта.
![]() —
Закон
Гей-Люссака.
—
Закон
Гей-Люссака.
![]() —
закон Шарля
(второй закон Гей-Люссака, 1808 г.)
—
закон Шарля
(второй закон Гей-Люссака, 1808 г.)
Основное уравнение мкт
![]() ,
где k
является постоянной
Больцмана
(отношение универсальной
газовой постоянной
R
к числу
Авогадро
NA),
i
— число степеней свободы молекул (i
= 3
в большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T
- абсолютная температура.
,
где k
является постоянной
Больцмана
(отношение универсальной
газовой постоянной
R
к числу
Авогадро
NA),
i
— число степеней свободы молекул (i
= 3
в большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T
- абсолютная температура.
Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) газовой системы с микроскопическими (масса молекул, средняя скорость их движения).
Вывод основного уравнения мкт
Пусть имеется кубический сосуд с ребром длиной l и одна частица массой m в нём.
Обозначим
скорость движения vx,
тогда перед столкновением со стенкой
сосуда импульс
частицы равен mvx,
а после — −
mvx,
поэтому стенке передается импульс p
= 2mvx.
Время, через которое частица сталкивается
с одной и той же стенкой, равно
![]() .
.
Отсюда
следует:![]()
Так
как давление
![]() ,
следовательно сила F
= p
* S
,
следовательно сила F
= p
* S
Подставив,
получим:
![]()
Преобразовав:
![]()
Так как рассматривается кубический сосуд, то V = Sl
Отсюда:
![]() .
.
Соответственно,
![]() и
и
![]() .
.
Таким
образом, для большого числа частиц верно
следующее:
![]() ,
аналогично для осей y и z.
,
аналогично для осей y и z.
Поскольку
![]() ,
то
,
то
![]() .
Это следует из того, что все направления
движения молекул
в хаотичной среде равновероятны.
.
Это следует из того, что все направления
движения молекул
в хаотичной среде равновероятны.
Отсюда
![]() или
или
![]() .
.
Пусть
![]() —
среднее значение кинетической энергии
всех молекул, тогда:
—
среднее значение кинетической энергии
всех молекул, тогда:
![]() ,
откуда
,
откуда
![]() .
.
Для
одного моля выражение примет вид
![]()
