
- •Основные законы химии
- •Строение атома.
- •Химическая связь. Строение молекул.
- •Элементы химической термодинамики.
- •1 Порядок
- •2 Порядок
- •Химическое равновесие и закон действующих масс.
- •Растворы
- •Осмотическое давление.
- •Индикаторы
- •Гидролиз
- •Взаимно-усиливающий гидролиз
- •Окислительно-восстановительные реакции.
Химия.
Преподаватель – Иванов Иван Иванович
Заведующая лабораторией – Королева Галина Борисовна
Слушатель – Никифоров Михаил Николаевич
АПМ-03 Курс 1. Семестр осенний. 2003 год.
Химия – наука о веществах, их строении, свойствах, превращениях, сопровождающихся изменением свойств веществ.
Превращения бывают: 1) Физические
(процессы, сопровождаемые изменением
физических свойств вещества). 2) Химические
(сопровождаются изменением строения
атомов и молекул, составляющих вещество.
В результате образуются новые вещества
с новыми свойствами. 2NaOH+H2SO4![]() Na2SO4
+ 2H20 + 113,7 Дж
(нейтрализация) 3) Физико-химические (не
сопровождаются коренной перестройкой
атомов и молекул (плавление, испарение).
4) Ядерные (сопровождаются коренной
перестройкой атомов, приводят к
возникновению новых химических элементов)
Na2SO4
+ 2H20 + 113,7 Дж
(нейтрализация) 3) Физико-химические (не
сопровождаются коренной перестройкой
атомов и молекул (плавление, испарение).
4) Ядерные (сопровождаются коренной
перестройкой атомов, приводят к
возникновению новых химических элементов)
Химические процессы классифицируются: 1) Синтез (соединения): а) NH3+HCl NH4Cl б) 2NO+O2 2NO2 2) Реакция разложения (анализа) а) (NH4)2+Cr2O2 Cr2O3+N2+4H2O+Q 3) Реакция обмена. Pb(CH3COO)2+2KI PbI2+2KCH3COO 4) Реакция вытеснения. CuSO4+Fe Cu+FeSO4 5) ОВР (4)
Вещество – одно из состояний материй. Материя – вещество и энергия. Вещества бывают простые и сложные.
Элемент – вид атомов с одинаковым зарядом ядра = порядковому номеру.
Аллотропия – существование вещества в нескольких формах.
Полиморфизм – существование сложных веществ в нескольких формах (оксид кремния – 13 модификаций)
Основные законы химии
В изолированных системах сумма масс энергий постоянна.
 .
.
Закон постоянства вещества. Каждый химический элемент имеет определенный и постоянный состав, независимо от способа получения
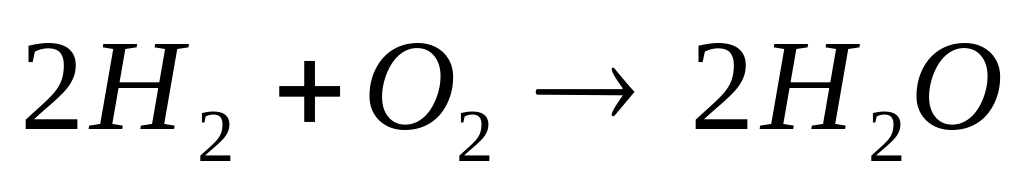 .
.Закон эквивалента. Любые вещества вступают в реакции в отношениях, пропорциональных их эквивалентам.
Эквивалент – количество вещества,
взаимодействующее с 1 молем атома
водорода или замещающий его в химических
реакциях. Масса эквивалента, выраженная
в граммах, называется эквивалентной
массой. [Э] [г/моль].
![]() .
В основаниях Э=М/2. В кислотах Э=М/3. В
солях Э=М/6. В оксидах Э=М/10.
.
В основаниях Э=М/2. В кислотах Э=М/3. В
солях Э=М/6. В оксидах Э=М/10.
Моль – количество вещества, содержащее столько структурных единиц (атом, молекул, ион), сколько атомов в 12 г стабильного изотопа углерода C12.
Закон Авогадро. При одинаковых физических условиях, в равных объемах газа содержится равное число молекул или атомов в случаях инертных газов (одноатомные газы).
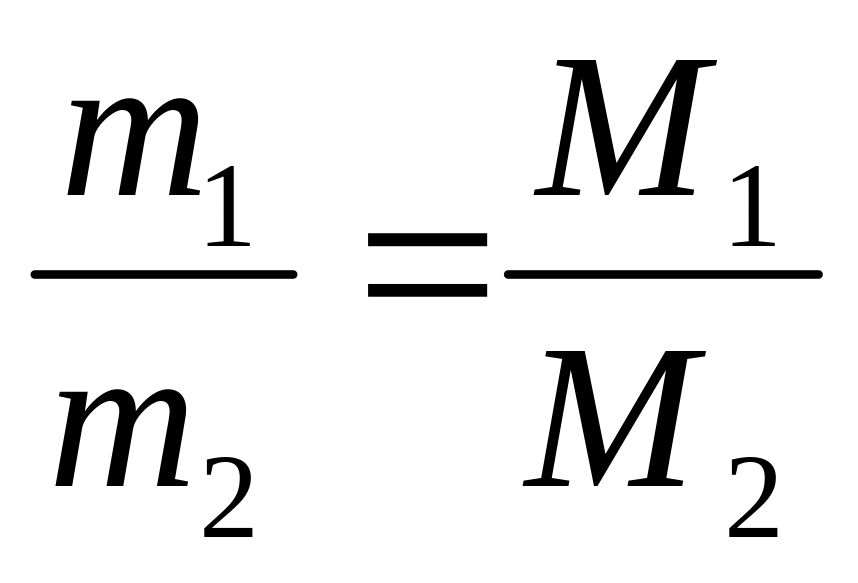 .
.
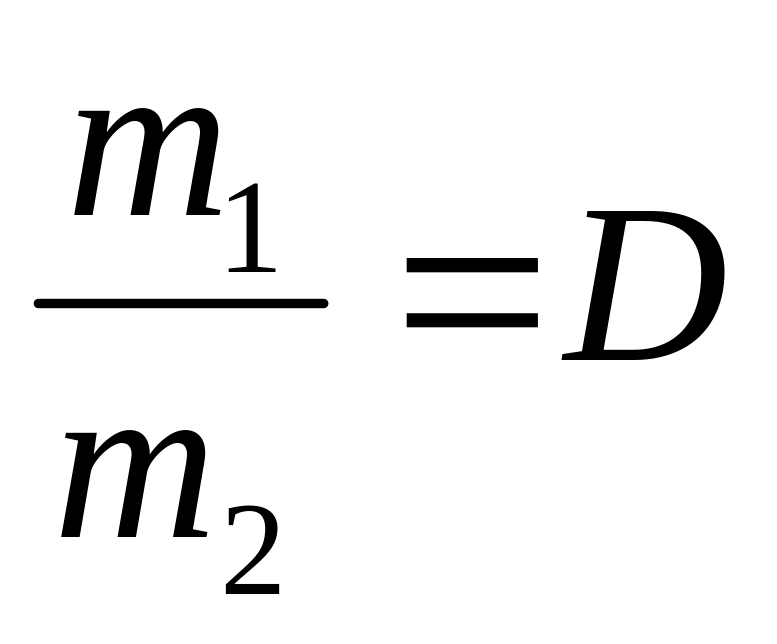 (плотность
первого газа по второму).
(плотность
первого газа по второму).
Номенклатура неорганических соединений.
H – гидрогениум, C – карбониум, О – оксигениум, N – нитрогениум, Ag – аргениум, Mn – манганум, Si – силигениум, S – сульфид, Fe – феррум, Cu – купрум, As – арсигениум, Sn – стану, Sb – стибию, Hg – гидраргиум.
Вещества классифицируют по свойствам: 1) Оксиды (солеобразующие (основные, кислотные, амфотерные) и несолеобразующие). 2) Гидроксиды (основания и кислоты) 3) Соли.
Кислоты классифицируют на: 1) 1-основная 2) 2-основная 3) 3-основная 4) 4-основная.
1) Бескислородные 2) Кислородсодержащие.
Кислота |
Анион |
Соль |
|||
Формула |
Название |
Формула |
Название |
Формула |
Название |
HF |
Второводородая |
F1- |
Вторидион |
CaF2 |
Вторид кальция |
H2SO3 |
Сернистая |
|
|
|
Сульфит |
H2S2O3 |
Тиосерная |
|
|
|
Тиосульфат |
H2S2O7 |
Пиросерная |
|
|
|
Пиросульфат |
H2S2O8 |
Пероксодвусерная |
|
|
|
Пероксодисульфат |
H2Se |
Селеноводородная |
|
|
|
Селенид |
H2SeO3 |
Селенистая |
|
|
|
Селенит |
H2SeO4 |
Селеновая |
|
|
|
Селенат |
H2SiO3 |
Кремниевая |
|
|
|
Силикат |
HVO3 |
Ванадиевая |
|
|
|
Ванадат |
H2S |
Сероводородная |
S2- |
Сульфидион |
CaOHF |
Вторид гидросокальция |
|
|
|
|
Ca(HS)2 |
Гидросульфид кальция |
HCN |
Циановодородная |
CN1- |
Цианидион |
Fe(CN)3 |
Цианид железа 3 |
MCNS |
Родановодородная |
CNS1- |
Роданид |
Fe(CNS)3 |
Роданид железа 3 |
HClO4 |
Хлорная |
ClO41- |
Пирохлорат |
MgOHClO4 |
Пирохлорат гидроксомагния |
HClO3 |
Хлорноватая |
ClO3 |
Хлорат |
Fe(OH)2ClO3 |
Хлоратдигидроксо железа 3 |
HClO2 |
Хлористая |
ClO2 |
Хлорид |
CaClO2 |
Хлорид кальция |
HClO |
Хлорноватистая |
ClO |
Гипохлорид |
CaClO |
Гипохлорид кальция |
HMnO4 |
Марганцовая |
MnO41- |
Перманганат |
KMnO4 |
Перманганат калия |
H2MnO4 |
Марганцовистая |
MnO42- |
Марганат |
KHMnO4 |
Гидроманганат калия |
H2SO4 |
Серная |
SO4 |
Сульфат |
CaH(SO4)2 |
Гидросульфат кальция |
H2SO3 |
Сернистая |
SO3 |
Сульфит |
Fe(OH)2SO3 |
Сульфат дигидроксожелеза |
H2CrO4 |
Хромовая |
CrO4 |
Хромат |
Ba(OH)2CrO4 |
Хромат дигидроксобария |
H2Cr2O7 |
2-х хромовая |
CrO7 |
Бидихромат |
(NH4)2Cr2O7 |
Дихромат |
HCrO2 |
Метахромистая |
|
|
|
Метахромит |
HI |
Иодоводород |
|
|
|
Йодид |
HOI |
йодноватистая |
|
|
|
Гипойодид |
HIO3 |
Йодноватая |
|
|
|
Йодат |
HIO4 |
йодная |
|
|
|
Перйрдат |
H2WO4 |
Вольфрамовая |
WO4 |
Вольфрамат |
CaWHO4 |
Гидровольфрамат кальция |
HN3 |
Азидоводород |
|
|
|
|
HNO3 |
Азотная |
NO3 |
Нитрат |
|
|
HNO2 |
Азотистая |
NO2 |
Нитрит |
|
|
H2P2O7 |
Пирофосфорная |
|
|
|
Дифосфат |
H3PO4 |
Ортофосфорная |
PO43- |
Ортофосфат |
Ca3(PO4)2 |
Ортофосфат |
H3PO2 |
Фосфорноватистая |
|
|
|
Гипофосфит |
|
|
|
|
|
|
HPO3 |
Метафосфорная |
PO31- |
Метафосфит |
Ca(PO3)2 |
Метафосфад |
H3PO3 |
фосфористая |
|
|
|
Фосфит |
HPO2 |
Метафосфористая |
PO2 |
Метафосфид |
CaOHPO2 |
Метафосфид гидроксокальция |
|
|
|
|
KBeO2 |
Бериллат калия |
|
|
|
|
Ca(HCO3)2 |
Гидрокарбонат кальция |
HCN |
Циановодородная |
CN |
Циано |
|
Цианид |
|
|
NH4 |
Аммоний |
|
|
HAlO3 |
Метаалюминиевая |
|
|
|
Метаалюминат |
HAsO3 |
Метамышьяковая |
|
|
|
Метаарсенат |
H3AsO4 |
Ортомышьяковая |
|
|
|
Ортоарсенат |
HAsO2 |
Метамышьяковистая |
|
|
|
Метаарсенит |
H3AsO3 |
Ортомышьяковистая |
|
|
|
Ортоарсенит |
HBO2 |
Метаборная |
|
|
|
Метаборат |
H3BO3 |
Ортоборная |
|
|
|
Ортоборат |
H2B4O7 |
Четырехборная |
|
|
|
Тетраборат |
H2C2O4 |
Щавельная |
|
|
|
Оксолат |
HOBr |
Бромноватистая |
|
|
|
Гипобромат |
HBrO3 |
Бромноватая |
|
|
|
Бромат |
HCOOH |
Муравьиная |
|
|
|
Формиат |
H2MoO4 |
Молибденовая |
|
|
|
Молибдат |
