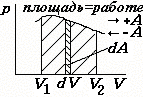- •Тема1. Кинематические характеристики движения.
- •Тема2. Кинематические ур-я движ-я.Равнопеременное движение.
- •Тема3. Кинематика вращательного движения точки.
- •Тема4. Кинематика абсолютно твердого тела.
- •Тема5. Законы Ньютона
- •Тема6. Закон сохранения импульса.
- •Тема 7. Работа. Мощность. Энергия.
- •Тема 8. Динамика абсолютно твердого тела.
- •Тема 9. Закон сохранения момента импульса.
- •Тема 10. Силовые поля.
- •Тема 11. Принципы относительности в механике.
- •2)Относительность одновременности событий
- •3)Замедление хода движущихся часов
- •Тема 12. Молекулярно-кинетические представления о строении вещества.
- •Тема 13. Классическая статика.
- •Тема 14. Явление переноса в газах.
- •Тема 15. Основные понятия термодинамики. Первое начало термодинамики.
- •Тема 16. Второе начало термодинамики.
- •Тема 17. Реальные газы.
- •Тема 18. Конденсированное состояние вещества.
Тема 15. Основные понятия термодинамики. Первое начало термодинамики.
1. Основные понятия в термодинамике.
Термодинамика – это раздел физики, в котором рассматриваются любые процессы (механические, электрические, магнитные, химические и др.) с учетом сопровождающих их тепловых явлений.
Термодинамика, как и молекулярная физика, применима только к системам, состоящим из очень большого числа частиц (нельзя применять законы термодинамики к 2-3 молекулам). В термодинамике не рассматривается поведение частиц внутри системы. Вся система изучается в целом и характеризуется едиными для системы характеристиками, например, теплоемкостью, диэлектрической или магнитной проницаемостью и пр.
В основе термодинамики лежат два начала (закона), полученные на основе опытных данных. I начало термодинамики – это по существу закон сохранения энергии с учетом тепловых явлений, II начало термодинамики определяет направление протекания физических процессов.
Термодинамическая система - это система, состоящее из большого числа частиц. Состояние системы описывается макропараметрами температура, давление, объем, намагниченность и многие другие. Термодинамическое равновесие или состояние термодинамического равновесия – это состояние, в которое самопроизвольно приходит система, находящаяся в неизменных внешних условиях.
Величины, которые зависят только от состояния системы и не зависят от процессов, посредством которых система пришла в данное состояние, называются функциями состояния. К таким величинам относятся: внутренняя энергия U, энтропия S, температура Т и др.
Работа и теплота – это две формы передачи энергии от одних тел к другим. При совершении работы меняется относительное расположение тел или частей тела. Передача энергии в виде теплоты осуществляется при контакте тел – за счет теплового движения молекул.
|
|
количество теплоты, передаваемое при нагревании (охлаждении) тела. |
с (Дж/кг.К) |
удельная теплоемкость - по смыслу – это количество теплоты, необходимое для нагревания единичной массы на один градус |
|
С (Дж/кмоль.К) |
молярная теплоемкость это количество теплоты, необходимое для нагревания одного киломоля (или моля) вещества на один градус |
|
|
связь между молярной и удельной теплоемкостями |
|
|
работа в газах (по определению): ( «+»А – работа газа «»А – работа внешних сил над газом |
|
|
|
только при постоянном давлении |
||
К внутренней энергии относят: 1)кинетическую энергию теплового движения молекул (но не кинетическую энергию всей системы в целом), 2)потенциальную энергию взаимодействия молекул между собой, 3)кинетическую и потенциальную энергию колебательного движения атомов в молекуле, 4)энергию связи электронов с ядром в атоме, 5)энергию взаимодействия протонов и нейтронов внутри ядра атома.
 Внутренняя
энергия идеального газа
– это кинетическая энергия теплового
движения его молекул. Она зависит только
от температуры газа.
Внутренняя
энергия идеального газа
– это кинетическая энергия теплового
движения его молекул. Она зависит только
от температуры газа.
|
|
изменение внутренней энергии идеального газа
2. Первое начало термодинамики.
1 |
«Теплота Q, сообщаемая системе идет на увеличение внутренней энергии dU системы и на работу A, совершаемую системой против внешних сил» |
|
2 |
«Изменение внутренней энергии dU системы происходит только за счет сообщения ей теплоты и (или) совершения над ней работы внешними силами»(А = А) |
|
3 |
«Невозможно построить вечный двигатель первого рода, т.е. такой периодически действующий двигатель, который совершал бы работу бóльшую, чем затраченная теплота» |
если система возвращается в исходное состояние, dU = 0 и A= Q |
Первое начало термодинамики «разрешает» построение такой тепловой машины, которая переводила бы всю затраченную теплоту в работу. Такая машина получила название вечного двигателя второго рода. Но согласно второму началу термодинамики создание такой машины невозможно. Иначе говоря, в любой тепловой машине всегда получается работы меньше, чем затрачивается энергии, часть затраченной энергии рассеивается в окружающей среде.
3. Применение первого начала термодинамики к изохорическому процессу.
Изохорический процесс. Его можно осуществить, нагревая газ при закрепленном поршне.
|
после сокращений получим выражение для теплоемкости СV |
|
|
|
молярная теплоемкость идеального газа при постоянном объеме она не зависит от температуры и определяется только числом степеней свободы молекул |
||
4. Применение первого начала термодинамики к изобарическому процессу.
Изобарический процесс.
|
подставим dQ, dU и А в I начало и после сокращений получим Ср |
|
|
молярная теплоемкость идеального газа при постоянном давлении – не зависит от температуры |
|
|
связь между
молярными теплоемкостями, Ср
СV
потому, что при
|
5. Применение первого начала термодинамики к изотермическому процессу.
Изотермический процесс.
|
|
6. Применение первого начала термодинамики к адиабатном процессе.
Адиабатический процесс – это процесс, происходящий без теплообмена с окружающей средой.
|
из I начала термодинамики; чтобы проинтегрировать это уравнение, надо «избавиться» от одной из переменных p,V, T. |
|||
|
найдем dT, продифференцировав уравнение Менделеева-Клапейрона и подставим в (1) |
|||
|
сокращая и учитывая, что , получим дифференциальное уравнение с двумя переменными p и V |
|||
|
разделим переменные, обозначим = Ср / СV и проинтегрируем; lnС – константа интегрирования |
|||
|
|
|
||
|
||||
|
||||
|
уравнения адиабатического процесса. |
|
|
|
|
показатель степени адиабаты или коэффициент Пуассона |
7. Работа при адиабатическом процессе.
Работу,
совершаемую при
адиабатическом процессе
можно найти, проинтегрировав уравнение
I
начала термодинамики:
![]() .
.
|
|
8. Теплоемкость идеального газа.
Из приведенных выше формул следует, что теплоемкость идеального газа не зависит от температуры газа, а определяется только числом степеней свободы молекул. Для многих одноатомных и двухатомных газов опыт подтверждает этот вывод для умеренных температур. Но при низких и высоких температурах наблюдается характерная зависимость теплоемкости от температуры.