
- •Углеводороды
- •Предельные (насыщенные) углеводороды
- •Непредельные углеводороды
- •Алканы (парафины)
- •Строение молекулы метана
- •Изомерия
- •Конформационная изомерия этана
- •Конформационная изомерия бутана
- •Получение
- •Физические свойства
- •Химические свойства
- •Механизм реакции бромирования алканов
- •Применение
- •Циклоалканы (циклопарафины)
- •Изомерия
- •Циклобутан, циклопентан и их конформации
- •Циклогексан и его конформации
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Электрофильное присоединение к алкенам
- •Реакция полимеризации
- •Радикальная полимеризация
- •Ионная или каталитическая полимеризация
- •Ионная полимеризация (катионная)
- •Ионная полимеризация (анионная)
- •Применение
- •Диеновые углеводороды (алкадиены)
- •Получение
- •Физические свойства
- •Химические свойства
- •Полимеризация диеновых соединений
- •Натуральный и синтетический каучуки
- •Ацетиленовые углеводороды (алкины)
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •I. Реакции присоединения
- •II. Кислотные свойства
- •Ароматические углеводороды (арены)
- •Строение бензола
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Электрофильное замещение в бензоле
- •Правила ориентации в бензольном ядре
- •Применение
- •Кислородсодержащие соединения
- •Спирты и фенолы
- •Физические свойства
- •Одноатомные спирты
- •Получение
- •Химические свойства
- •I. Реакции с разрывом связи ro–h
- •II. Реакции с разрывом связи r–oh.
- •III. Реакции окисления
- •IV. Дегидратация
- •Применение
- •Получение
- •Химические свойства
- •Применение
- • Жиры карбоновые кислоты
- •Получение
- •Химические свойства
- •Применение
- • Карбоновые кислоты жиры
- •Физические свойства
- •Химические свойства
- •Карбонильные соединения альдегиды и кетоны
- •Альдегиды
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Номенклатура
- •Изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Пептиды. Белки
- •Химические свойства
- •Моносахариды
- •Углеводы. Генетический d- ряд сахаров
- •Генетический d- ряд сахаров
- •Построение формул Хеуорса для d- галактозы
- •Получение
- •Физические свойства
- •Химические свойства
- •I. Реакции по карбонильной группе
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •Дисахариды
- •Полисахариды
- •Крахмал
- •Целлюлоза (клетчатка)
Изомерия
Наряду с изомерией, обусловленной строением углеродного скелета и положением функциональных групп, для - аминокислот характерна оптическая (зеркальная) изомерия. Все - аминокислоты, кроме глицина, оптически активны. Например, аланин имеет один асимметрический атом углерода (отмечен звездочкой),
H2N – |
H I C*–COOH I CH3 |
а значит, существует в виде оптически активных энантиомеров:
H─ |
COOH ┼─NH2 CH3 |
D- аланин
H2N─ |
COOH ┼─H CH3 |
L- аланин
Все природные - аминокислоты относятся к L– ряду.
Получение
1) Важнейший источник аминокислот – природные белки, при гидролизе которых образуются смеси - аминокислот. Разделение этой смеси – довольно сложная задача, однако по обыкновению одна или две аминокислоты образуются в значительно больших количествах, чем все другие, и их удается выделить достаточно просто.
2) Синтез аминокислот из галогенозамещенных кислот действием аммиака
Cl– |
CH–COOH + 2NH3 H2N– I R |
CH–COOH + NH4Cl I R |
3) Микробиологический синтез. Известны микроорганизмы, которые в процессе жизнедеятельности продуцируют - аминокислоты белков.
Физические свойства
Аминокислоты представляют собой кристаллические вещества с высокими (выше 250С) температурами плавления, которые мало отличаются у индивидуальных аминокислот и поэтому нехарактерны. Плавление сопровождается разложением вещества. Аминокислоты хорошо растворимы в воде и нерастворимы в органических растворителях, чем они похожи на неорганические соединения. Многие аминокислоты обладают сладким вкусом.
Химические свойства
1) Некоторые свойства аминокислот, в частности высокая температура плавления, объясняется своеобразным их строением. Кислотная (–COOH) и основная (–NH2) группы в молекуле аминокислоты взаимодействуют друг с другом, образуя внутренние соли (биполярные ионы). Например, для глицина
H2N-CH2-COOH
H3N+-CH2-COO-
|
2) Вследствие наличия в молекулах аминокислот функциональных групп кислотного и основного характера - аминокислоты являются амфотерными соединениями, т.е. они образуют соли как с кислотами, так и со щелочами.
H2N– |
CH–COOH + HCl [H3N+– I R |
CH–COOH]Cl-(хлористоводородная соль -аминокислоты) I R |
H2N– |
CH–COOH + NaOH H2N– I R |
CH–COO-Na+(натриевая соль -аминокислоты) + H2O I R |
3) В реакции со спиртами образуются сложные эфиры.
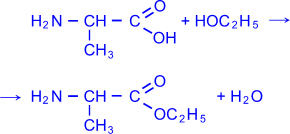 Этиловый
эфир аланина
Этиловый
эфир аланина
4) - Аминокислоты можно ацилировать, в частности, ацетилировать, действуя уксусным ангидридом или хлористым ацетилом. В результате образуются N- ацильные производные - аминокислот (символ "N" означает, что ацил связан с атомом азота).
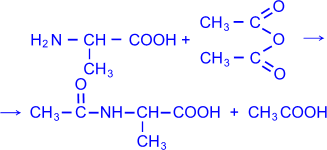 N
– ацетилаланин
N
– ацетилаланин
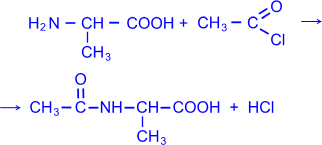
5) - Аминокислоты вступают друг с другом в реакцию поликонденсации, приводя к амидам кислот. Продукты такой конденсации называются пептидами. При взаимодействии двух аминокислот образуется дипептид:
H2N– |
H I CH– |
O II C–OH + H–NH– |
CH3 I CH– |
O II C–OH |
|
глицин |
аланин |
||
H2N– |
H I CH– |
O II C–NH– |
CH3 I CH– |
O II C–OH + H2O |
|
глицилаланин |
|
||
При конденсации трех аминокислот образуется трипептид и т.д.
-
Связь –
O II C–NH – называется пептидной связью.
