- •Углеводороды
- •Предельные (насыщенные) углеводороды
- •Непредельные углеводороды
- •Алканы (парафины)
- •Строение молекулы метана
- •Изомерия
- •Конформационная изомерия этана
- •Конформационная изомерия бутана
- •Получение
- •Физические свойства
- •Химические свойства
- •Механизм реакции бромирования алканов
- •Применение
- •Циклоалканы (циклопарафины)
- •Изомерия
- •Циклобутан, циклопентан и их конформации
- •Циклогексан и его конформации
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Электрофильное присоединение к алкенам
- •Реакция полимеризации
- •Радикальная полимеризация
- •Ионная или каталитическая полимеризация
- •Ионная полимеризация (катионная)
- •Ионная полимеризация (анионная)
- •Применение
- •Диеновые углеводороды (алкадиены)
- •Получение
- •Физические свойства
- •Химические свойства
- •Полимеризация диеновых соединений
- •Натуральный и синтетический каучуки
- •Ацетиленовые углеводороды (алкины)
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •I. Реакции присоединения
- •II. Кислотные свойства
- •Ароматические углеводороды (арены)
- •Строение бензола
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Электрофильное замещение в бензоле
- •Правила ориентации в бензольном ядре
- •Применение
- •Кислородсодержащие соединения
- •Спирты и фенолы
- •Физические свойства
- •Одноатомные спирты
- •Получение
- •Химические свойства
- •I. Реакции с разрывом связи ro–h
- •II. Реакции с разрывом связи r–oh.
- •III. Реакции окисления
- •IV. Дегидратация
- •Применение
- •Получение
- •Химические свойства
- •Применение
- • Жиры карбоновые кислоты
- •Получение
- •Химические свойства
- •Применение
- • Карбоновые кислоты жиры
- •Физические свойства
- •Химические свойства
- •Карбонильные соединения альдегиды и кетоны
- •Альдегиды
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Применение
- •Номенклатура
- •Изомерия
- •Физические свойства
- •Получение
- •Химические свойства
- •Применение
- •Изомерия
- •Получение
- •Физические свойства
- •Химические свойства
- •Пептиды. Белки
- •Химические свойства
- •Моносахариды
- •Углеводы. Генетический d- ряд сахаров
- •Генетический d- ряд сахаров
- •Построение формул Хеуорса для d- галактозы
- •Получение
- •Физические свойства
- •Химические свойства
- •I. Реакции по карбонильной группе
- •II. Реакции по гидроксильным группам
- •III. Специфические реакции
- •Дисахариды
- •Полисахариды
- •Крахмал
- •Целлюлоза (клетчатка)
Применение
Этиленгликоль применяют:
1) в качестве антифриза;
2) для синтеза высокомолекулярных соединений (например, лавсана).
Глицерин применяют:
1) в парфюмерии и в медицине (для изготовления мазей, смягчающих кожу);
2) в кожевенном производстве и в текстильной промышленности;
3) для производства нитроглицерина.
Фенолы
Фенолы содержат гидроксил непосредственно связанный с атомом углерода ароматического кольца. По числу гидроксильных групп, присоединенных к кольцу, фенолы подразделяются на одно-, двух- и многоатомные.
Изомерия фенолов обусловлена взаимным положением заместителей в бензольном кольце.
орто-крезол 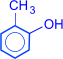 мета-крезол
мета-крезол  пара-крезол
пара-крезол ![]()
Получение
Фенол в промышленности получают:
1) окислением изопропилбензола (кумола) в гидроперекись с последующим разложением её серной кислотой.
CH3 I |
|
CH3 I |
|
|
|
|
|
H3C–CH |
|
H3C–C–O–OH |
|
OH |
|
O |
|
|
O2 |
|
H2SO4 |
|
|
II |
|
|
––– |
+ H3C– |
C |
–CH3 |
2) из бензола по способу Рашига:
|
HCl + O2 |
|
H2O(Cu2+) |
|
–––––– |
–––––– |
|||
-H2O |
-HCl |
Химические свойства
1. Кислотные свойства у фенолов выражены сильнее, чем у спиртов. В результате сопряжения неподелённой пары электронов кислородного атома с - электронной системой ароматического кольца, электронная плотность О-атома перемещается частично на связь С–О, увеличивая при этом электронную плотность в бензольном ядре (в особенности в орто- и пара-положениях). Электронная пара связи О–Н сильнее притягивается к атому кислорода, способствуя тем самым созданию большего положительного заряда на атоме водорода гидроксильной группы и, следовательно, отщеплению этого водорода в виде протона.
H+ |
|
Фенолы, в отличие от спиртов, образуют феноляты не только при взаимодействии с активными металлами, но и с водными растворами щелочей.
2 |
|
OH + 2Na |
2 |
|
ONa(фенолят натрия) + H2 |
|
OH + NaOH |
|
ONa + H2O |
Образование фиолетового окрашивания при добавлении раствора FeCl3 служит качественной реакцией, идентифицирующей фенолы:
|
|
|
|
|
|
|
3 |
|
OH + FeCl3 |
|
O–Fe |
|
+ 3 HCl |
|
|
|
|
|
|
|
Фенолы – очень слабые кислоты, поэтому феноляты легко гидролизуются и разрушаются не только сильными, но и очень слабыми кислотами:
|
ONa + H2SO4 |
|
OH + NaHSO4 |
|
ONa + CO2 + H2O |
|
OH + NaHCO3 |
Фенолы образуют простые эфиры (синтез Вильямсона) и сложные эфиры
|
O |
Na + Br- |
-CH2–CH3 |
|
O–CH2–CH3(этилфениловый эфир) + NaBr |
и сложные эфиры
|
|
|
O II |
|
|
O II |
|
O |
H + Cl- |
-C–CH3(хлорангидрид укс.кислоты) |
|
O– |
C–CH3(фениловый эфир укс.кислоты) + HCl |
2. Реакции бензольного кольца. Гидроксильная группа у фенолов является очень сильным орто- и пара-ориентантом. Реакции замещения атомов водорода в бензольном кольце протекают в более мягких условиях, чем у бензола. При бромировании и нитровании могут быть получены 2,4,6-тризамещенные производные
OH |
|
|
OH |
|
OH |
|
|
+ 3H2O |
3HNO3 ––– H2SO4 |
|
3Br2 ––– |
|
+ 3HBr |
NO2 |
|
|
|
|
Br |
|
2,4,6 – тринитро- фенол (пикриновая кислота) |
|
|
|
|
2,4,6–трибром- фенол |
|
3. Гидрирование.
OH |
|
OH |
|
3H2 –– Ni |
|