
2. Электролитическая диссоциация
Электролиты и их диссоциация
Вещества, распадающиеся на ионы в расплавах или растворах и поэтому проводящие электрический ток, называются электролитами. Электролитами являются соединения с ионной или полярной связью – соли, кислоты, основания. Распад электролитов на ионы в водном растворе называют электролитической диссоциацией. С учетом особенностей диссоциации в водном растворе веществ различных классов могут быть даны их определения.
Кислоты – вещества, при диссоциации которых образуются катионы Н+ и анионы кислотных остатков. Основность кислот оценивается количеством ионов Н+ , способных отщепляться при диссоциации молекулы кислоты.
Основания – вещества, при диссоциации которых образуются анионы ОН¯ и катионы металлов. Растворимые в воде основания называют щелочами.
Средние соли – вещества, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Кислые соли – вещества, при диссоциации которых могут образовываться катионы металлов, водорода и анионы кислотных остатков.
Все электролиты делятся на сильные и слабые. Количественно силу электролитов оценивают по величине степени их диссоциации. Степень диссоциации электролита (α) – это отношение числа его молей (n), распавшихся в растворе на ионы, к общему числу молей (υ) растворенного вещества
α
=
 %.
%.
Степень диссоциации зависит от природы электролита, концентрации раствора и температуры. Она увеличивается с уменьшением концентрации и повышением температуры. В разбавленных растворах сильные электролиты диссоциируют практически полностью. В случае ионных соединений уже в процессе их растворения образуются ионы, которые и переходят в раствор, т.е. при любой концентрации такого раствора в нем содержатся только ионы. В растворах слабых электролитов возникает равновесие между недиссоциированными молекулами и образующимися при диссоциации ионами.
К числу сильных электролитов относятся практически все растворимые соли, многие кислоты (например, HCl, HNO3, H2SO4) и растворимые основания (например, NaOH, KOH, Ca(OH)2, Ba(OH)2). Слабые электролиты, содержащие многозарядные ионы, диссоциируют ступенчато, по стадиям. При этом легче идет диссоциация по первой стадии.
Концентрацию электролита и концентрации образующихся при его диссоциации ионов принято выражать в моль/л.
Пример 1. Напишите уравнения электролитической диссоциации сильных электролитов: HNO3, H2SO4, Ca(OH)2, Fe(NO3)3.
Р е ш е н и е. HNO3 H++NO3¯; Ca(OH)2Ca2++2OH¯;
H2SO42H++SO42¯; Fe(NO3)3Fe3++3NO3¯.
Пример 2. Напишите уравнения электролитической диссоциации слабых электролитов: H2SO3, H3PO4.
Р е ш е н и е. H2SO3H++HSO3¯; HSO3¯H++SO32¯;
H3PO4H++H2PO4¯; H2PO4¯H++ HPO42¯; HPO42¯H++ PO43¯.
Пример 3. Сколько ионов водорода и сколько молей ионов водорода образуется при полной диссоциации 2 моль серной кислоты?
Р е ш е н и е. Согласно уравнению диссоциации

из 2 моль H2SO4 образуется 4 моль ионов H+.
Учитывая, что в 1 моль вещества содержится 6*1023 частиц (молекул, ионов), можно найти, какое число ионов содержится в 4 моль ионов H+.
В 1 моль вещества содержится 6*1023 ионов
В 4 моль вещества содержится x ионов
Откуда
 (ионов
H+).
(ионов
H+).
Пример 4. Сколько молей ионов водорода образуется в растворе, содержащем 1 моль HNO2, если степень диссоциации кислоты равна 2 %?
Р е ш е н и е. Определим, сколько молей кислоты продиссоциировало, приняв во внимание степень диссоциации кислоты.
1 моль HNO2 составляет 100%
x моль HNO2 составляет 2%
Откуда
 (моль).
(моль).
Расчет можно провести, используя формулу:
α
=
 (моль).
(моль).
Из уравнения диссоциации


следует, что при диссоциации 0,02 моль HNO2 образуется 0,02 моль ионов H+.
Пример 5. Вычислите концентрацию (в моль/л) ионов Cu2+ в 1,6%-ом растворе CuSO4, приняв плотность раствора равной 1 г/см3.
Р е ш е н и е. Найдем массу сульфата меди, содержащегося в 1 л раствора, учитывая, что масса такого раствора равна 1000 г (1000 мл *1 г/мл):
в 100 г раствора содержится 1,6 г CuSO4
в 1000 г раствора содержится x г CuSO4
Откуда
 (г).
(г).
Это составит 0,1 моль CuSO4 (16 г : 160 г/моль, где 160 г/моль – молярная масса CuSO4). Из уравнения диссоциации CuSO4 (соли в разбавленных растворах диссоциируют полностью)

следует, что при диссоциации 0,1 моль CuSO4 образуется 0,1 моль ионов Cu2+.
Пример 6. Вычислите суммарное число молей ионов Fe3+ и NO3¯, образующихся в 1 л раствора, который содержит 0,15 моль Fe(NO3)3.
Р е ш е н и е. Учитывая, что соли – сильные электролиты, согласно уравнению диссоциации
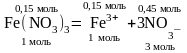
из 0,15 моль Fe(NO3)3 образуется 0,15 моль ионов Fe3+ и 0,45 моль ионов NO3¯, что в сумме составит 0,6 моль ионов.
Пример 7. В 1 л раствора содержится 0,3 моль хлорида натрия и 0,1 моль фосфата калия. Сколько хлорида калия и фосфата натрия (в моль) необходимо взять, чтобы приготовить 1 л раствора такого же состава?
Р е ш е н и е. Из уравнений диссоциации солей NaCl и K3PO4

следует, что в 1 л раствора содержится по 0,3 моль ионов Na+, K+ и Cl¯ и 0,1 моль ионов PO43¯.
Чтобы при замене солей число ионов не изменилось, в растворе должно содержаться, как следует из уравнений диссоциации

0,3 моль KCl и 0,1 моль Na3PO4.
2-1. Какие из веществ — поваренная соль, фосфорная кислота, водород, гидроксид натрия, сульфат калия, оксид азота (II), сернистая кислота, сахар – являются электролитами?
2-2. Какие из названных ниже веществ могут быть отнесены к сильным, какие — к слабым электролитам:
а) NaF, KCl, LiBr (ионные соединения); б) HCl, НСlO4, H2SO4 (соединения с сильно полярными связями); в) Н2СO3, Be(ОН)2, H2S (соединения со слабо полярными связями); г) СН4, N2, О2 (соединения с неполярными связями)?
*2-3. Как можно объяснить, что одно и то же вещество, растворенное в одном растворителе, диссоциирует, в другом — нет? В каком растворителе — а) водном (молекулы Н2О полярны); б) бензольном (молекулы С6Н6 неполярны) —диссоциирует СuСl2?
2-4. Почему не проводит электрический ток чистая вода?
*2-5. Почему жидкие НСl и SO2 не проводят, а их водные растворы проводят электрический ток?
2-6. Какое из приведенных ниже уравнений отражает процесс электролитической диссоциации:
а) 2Н2O= Н2 + O2;
б) Н2O=Н+ + OН¯;
в) 2Н2О + 2Na = 2NaOH + Н2;
г) H++OH¯=H2O?
2-7. Какая из приведенных ниже схем наиболее полно отображает сущность процесса электролитической диссоциации бромоводородной кислоты:
а) НВr = Н+ + Вr¯;
б) НВr + Н2O = Н3O++ Вr¯;
в) НВr + аН2O [Н3O (Н2O) п] + + [Вr (Н2O) т]¯?
Какую схему наиболее часто используют?
2-8. Напишите уравнения диссоциации: а) сильных одноосновных кислот HI и НС1O4; б) слабых одноосновных кислот HF и НСlO.
2-9. Напишите уравнения диссоциации в разбавленном растворе: а) сильных многоосновных кислот H2SO4, H2SeO4; б) слабых многоосновных кислот H2S, Н2СO3. Почему диссоциация слабых кислот по каждой последующей стадии протекает в меньшей степени, чем по предыдущей?
2-10. Напишите уравнения диссоциации сильных оснований: NaOH и Sr(OH)2.
*2-11. Как можно объяснить наличие амфотерных свойств у ряда гидроксидов? Как практически подтверждается амфотерный характер гидроксидов?
2-12. Напишите уравнения реакций, иллюстрирующих амфотерные свойства гидроксидов цинка и алюминия.
2-13. Как изменяются основные свойства гидроксидов элементов с увеличением их порядкового номера: а) в периоде; б) в группе?
*2-14. Какое из приведенных ниже определений правильно? Средняя соль — это вещество, при диссоциации которого образуются: а) катионы водорода и анионы кислотного остатка; б) катионы металла и гидроксид-анионы; в) катионы водорода, металла и анионы кислотного остатка; г) катионы металла и анионы кислотного остатка.
2-15. Напишите уравнения электролитической диссоциации солей: а) хлорида алюминия; б) сульфата железа (III); в) карбоната калия; г) нитрата меди (II); д) фосфата натрия.
2-16. Напишите уравнения электролитической диссоциации кислых солей: а) гидросульфата натрия; б) гидросульфата магния; в) гидрокарбоната кальция; г) гидрокарбоната калия; д) дигидрофосфата калия; е) гидрофосфата натрия.
2-17. Напишите уравнения электролитической диссоциации основных солей: a) MgOHCl; б) A1(OH)2NO3; в) FeOHSO4; г) (ZnOH)2SO4; д) CrOH(NO3)2; е) FeOHCl2.
2-18. Расположите в ряд по мере увеличения числа ионов, образующихся при диссоциации 1 моль соли, формулы: a) Fe2(SO4)3; б) FeCl2; в) Fe(NO3)3.
2-19. В растворе какой из кислот одинаковой концентрации (моль/л) — серной или сероводородной, азотной или азотистой — содержится большее число ионов водорода?
*2-20. Чем объяснить, что при разбавлении концентрированной соляной кислоты водой электропроводность раствора первоначально повышается, а затем - понижается?
*2-21. Какие из перечисленных ниже фактов влияют на степень диссоциации электролитов: а) природа электролита; б) концентрация раствора; в) температура раствора; г) природа растворителя; д) атмосферное давление?
2
2-23. Сколько моль ионов SO42¯ образуется при полной диссоциации 0,01 моль Fe2(SO4)3?
2-24. Сколько моль ионов Н+ образуется в растворе, содержащем 0,001 моль НСlO, если степень диссоциации кислоты равна 1 %?
2-25. Сколько моль ионов Н+ образуется в растворе, содержащем 0,01 моль H2S, если степень диссоциации сероводородной кислоты в растворе по первой ступени равна 0,3 % (диссоциацией по второй ступени пренебречь)?
2-26. Сколько моль ионов NO3¯ образуется при полной диссоциации 0,01 моль Mg(NO3)2?
*2-27. Вычислите концентрацию ионов Na+ (в моль/л) в 1,17%-ом растворе NaCl, приняв плотность раствора равной 1 г/см3.
*2-28. Вычислите концентрацию ионов Сl¯ (в моль/л) в 1,14%-ом растворе MgCl2, приняв плотность раствора равной 1 г/см3.
2-29. Вычислите суммарное число моль ионов Nа+ и SO42¯, которые образуются в растворе, содержащем 1 моль Na2SO4.
2-30. Вычислите суммарное число моль ионов Н+ и HSO3¯, которые образуются в растворе, содержащем 0,1 моль H2SO3. Степень диссоциации кислоты в растворе по первой ступени равна 40% (диссоциацией по второй ступени пренебречь).
*2-31. В 1 л раствора содержится 0,2 моль нитрата натрия и 0,1 моль сульфата калия. Сколько нитрата калия и сульфата натрия (в моль) необходимо взять, чтобы приготовить 1 л раствора такого же состава?
*2-32. В 1 л раствора содержится 0,1 моль хлорида калия и 0,05 моль карбоната натрия. Сколько хлорида натрия и карбоната калия (в моль) нужно взять, чтобы приготовить 1 л раствора такого же состава?
Ионные уравнения
Реакции в водных растворах электролитов являются реакциями между ионами. Уравнения таких реакций называют ионными уравнениями. При написании ионных уравнений формулы малодиссоциирующих, малорастворимых и газообразных веществ записывают в молекулярной форме, формулы хорошо растворимых и хорошо диссоциирующих в растворе веществ – в ионной форме. Реакции обмена в растворах электролитов протекают практически необратимо в сторону образования малодиссоциирующих (слабые электролиты), малорастворимых (выпадает осадок), газообразных (выделяется газ) веществ.
Пример. Напишите молекулярное и ионное уравнения реакции взаимодействия в растворе хлорида бария и сульфата натрия.
Р е ш е н и е. Молекулярное уравнение:

Стрелка при BaSO4 указывает на то, что в водном растворе это соединение выпадает в осадок.
Напишем уравнение в ионной форме:
Ba2++2Cl¯+2Na++SO42¯= BaSO4+2Na++2Cl¯.
Сократим в левой и правой частях уравнения формулы одинаковых ионов. Получим ионное уравнение:
Ba2++SO42¯= BaSO4
Можно сразу записывать конечное ионное уравнение, минуя промежуточную стадию. Промежуточное уравнение называют полным ионным уравнением, конечное – сокращенным ионным уравнением.
2-33. Напишите ионные уравнения реакций, протекающих с образованием труднорастворимых веществ:
а) CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4;
б) Al2(SO4)3 + 3Са(OH)2 = 2А1(OH)3 + 3CaSO4.
2-34. Напишите ионные уравнения реакций, протекающих с образованием малодиссоциирующих веществ:
а) NaNO2 + HCl = HNO2 + NaCl;
б) H2SO4 + 2NaOH = Na2SO4 + 2Н2O.
2-35. Напишите ионные уравнения следующих реакций:
а) Сu(ОН)2 + 2HNO3 = Сu(NO3)2+2Н2O;
б) Ba(OH)2 + H2SO4 = BaSO4 +2Н2O;
в) Zn(OH)2 + 2NaOH = Na2 [Zn(OH)4];
г) H2SO4+ 2КОН = K2SO4 + 2Н2O.
2-36. Напишите молекулярные и ионные уравнения реакций, протекающих при сливании растворов: а) гидроксида калия и соляной кислоты; б) гидроксида лития и азотной кислоты; в) гидроксида кальция и серной кислоты.
2-37. Напишите молекулярные уравнения следующих реакций:
а) Ва2+ + СО32¯ = ВаСO3;
б) Mg2+ + 2OН¯ = Mg (ОН)2;
в) Ag+ + I¯ = AgI;
г) НСO3¯+ Н+ = СO2 + Н2O;
д) Ba(OH)2 + 2H+ = Be2++2H2O;
е) Zn+2H+ = Zn2+ + Н2.
2-38. Закончите молекулярные и напишите ионные уравнения следующих реакций:
а) СаСO3 + НС1; г) H2S + NaOH;
б) Fe + H2SO4; д) SO2 + KOH;
в) Zn (ОН)2 + HNO3; е) СO2 + Са(OН)2.
2-39. Закончите ионные и напишите молекулярные уравнения следующих реакций:
а) Сr3+ + ... Сr(ОН)3; г) СO32¯ + ... СаСО3;
б) Рb2++ ... PbS; д) SO42¯ + ... SrSO4;
в) Ag++…AgCl; е) S2¯ +... CuS.
2-40. Будут ли протекать в растворе следующие реакции обмена:
а) Са(NO3)2+ NaCl; г) Cu(NO3)2 + KOH;
б) ВаС12 + MgSO4; д) NaOH + KCl;
в) K2SO4 + Ba(NO3)2; е) Са (ОН)2 + НСl.
