
- •Распределение Максвелла
- •[Править] Распределение Максвелла [править] Распределение по вектору импульса
- •[Править] Границы применимости
- •[Править] Условия классического рассмотрения
- •Барометрическая формула
- •Распределение Максвелла и распределение Больцмана
- •Распределение Максвелла Править
- •Распределение Больцмана Править
[Править] Распределение Максвелла [править] Распределение по вектору импульса
Представленное ниже очень сильно отличается от вывода, предложенного Джеймсом Клерком Максвеллом и позже описанного с меньшим количеством предположений Людвигом Больцманом.
В случае идеального газа, состоящего из не взаимодействующих атомов в основном состоянии, вся энергия находится в форме кинетической энергии. Кинетическая энергия соотносится с импульсом частицы следующим образом
![]() ,
,
где
![]() —
квадрат вектора импульса
—
квадрат вектора импульса
![]() .
.
Мы можем поэтому переписать уравнение (1) как:
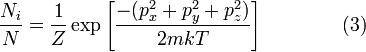 ,
,
где
![]() —
статсумма,
соответствующая знаменателю в уравнении
(1),
—
статсумма,
соответствующая знаменателю в уравнении
(1),
![]() —
молекулярная масса газа,
—
термодинамическая температура, и
—
постоянная
Больцмана. Это распределение
—
молекулярная масса газа,
—
термодинамическая температура, и
—
постоянная
Больцмана. Это распределение
![]() пропорционально
функции
плотности вероятности
пропорционально
функции
плотности вероятности
![]() нахождения
молекулы в состоянии с этими значениями
компонентов импульса. Таким образом:
нахождения
молекулы в состоянии с этими значениями
компонентов импульса. Таким образом:
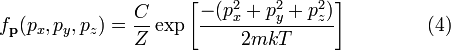
Постоянная
нормировки C, определяется из условия,
в соответствии с которым вероятность
того, что молекулы имеют какой-либо
вообще импульс, должна быть равна
единице. Поэтому интеграл уравнения
(4) по всем значениям
![]() и
и
![]() должен
быть равен единице. Можно показать, что:
должен
быть равен единице. Можно показать, что:
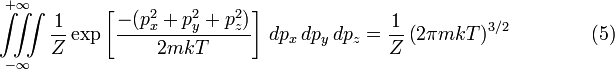 .
.
Таким образом, чтобы интеграл в уравнении (4) имел значение 1 необходимо, чтобы
![]() .
.
Подставляя
выражение (6) в уравнение (4) и используя
тот факт, что
![]() ,
мы получим
,
мы получим
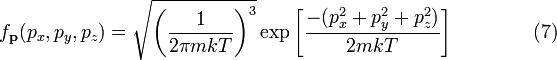 .
.
[править] Распределение по вектору скорости
Учитывая,
что плотность распределения по скоростям
![]() пропорциональна
плотности распределения по импульсам:
пропорциональна
плотности распределения по импульсам:
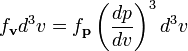
и
используя
![]() мы
получим:
мы
получим:
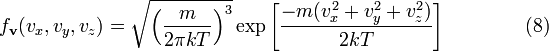 ,
,
что
является распределением Максвелла по
скоростям. Вероятность обнаружения
частицы в бесконечно малом элементе
![]() около
скорости
около
скорости
![]() равна
равна
![]()
[править] Распределение по абсолютной величине импульса
Интегрируя, мы можем найти распределение по абсолютной величине импульса
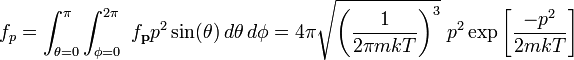
[править] Распределение по энергии
Наконец,
используя соотношения
![]() и
и
![]() ,
мы получаем распределение по кинетической
энергии:
,
мы получаем распределение по кинетической
энергии:
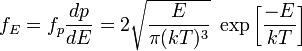
[править] Распределение по проекции скорости
Распределение
Максвелла для вектора скорости
![]() —
является произведением распределений
для каждого из трех направлений:
—
является произведением распределений
для каждого из трех направлений:
![]() ,
,
где распределение по одному направлению:
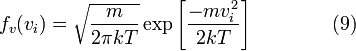
Это распределение имеет форму нормального распределения. Как и следует ожидать для покоящегося газа, средняя скорость в любом направлении равна нулю.
[править] Распределение по модулю скоростей
Обычно, более интересно распределение по абсолютному значению, а не по проекциям скоростей молекул. Модуль скорости, v определяется как:
![]()
поэтому
модуль скорости всегда будет больше
или равен нулю. Так как все
![]() распределены
нормально, то
распределены
нормально, то
![]() будет
иметь хи-квадрат
распределение с тремя степенями
свободы. Если
будет
иметь хи-квадрат
распределение с тремя степенями
свободы. Если
![]() —
функция
плотности вероятности для
модуля скорости, то:
—
функция
плотности вероятности для
модуля скорости, то:
![]() ,
,
где
![]()
таким образом, функция плотности вероятности для модуля скорости равна
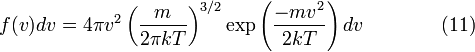
[править] Характерная скорость
Хотя Уравнение (11) дает распределение скоростей, или, другими словами, долю молекул, имеющих специфическую скорость, часто более интересны другие величины, такие как средние скорости частиц. В следующих подразделах мы определим и получим наиболее вероятную скорость, среднюю скорость и среднеквадратичную скорость.
[править] Наиболее вероятная скорость
наиболее
вероятная скорость,
![]() —
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению
—
вероятность обладания которой любой
молекулой системы максимальна, и которая
соответствует максимальному значению
![]() .
Чтобы найти её, необходимо вычислить
.
Чтобы найти её, необходимо вычислить
![]() ,
приравнять её нулю и решить относительно
,
приравнять её нулю и решить относительно
![]() :
:
![]()
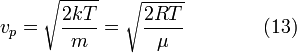
[править] Средняя скорость
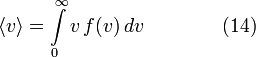
Подставляя и интегрируя, мы получим
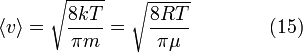
[править] Среднеквадратичная скорость
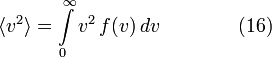
Подставляя и интегрируя, мы получим
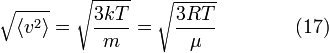
[править] Вывод распределения по Максвеллу
Получим
теперь формулу распределения так, как
это делал сам Джеймс
Клерк Максвелл[источник не указан 523 дня].
Рассмотрим
пространство скоростных точек (каждую
молекулу представляем как точку в
системе координат
![]() )
в стационарном
состоянии газа. Выберем бесконечно
малый элемент объема
)
в стационарном
состоянии газа. Выберем бесконечно
малый элемент объема
![]() .
Так как газ стационарный, количество
скоростных точек в
остается
неизменным с течением времени. Пространство
скоростей изотропно,
поэтому функции плотности
вероятности для всех направлений
одинаковы.
.
Так как газ стационарный, количество
скоростных точек в
остается
неизменным с течением времени. Пространство
скоростей изотропно,
поэтому функции плотности
вероятности для всех направлений
одинаковы.
![]()
Максвелл
предположил, что распределения скоростей
по направлениям статистически независимы,
то есть компонента
![]() скорости
молекулы не зависит от
скорости
молекулы не зависит от
![]() и
и
![]() компонент.
компонент.
![]() -
фактически вероятность нахождения
скоростной точки в объеме
.
-
фактически вероятность нахождения
скоростной точки в объеме
.
![]()
![]()
![]()
![]()
Правая
часть не зависит от
![]() и
и
![]() ,
значит и левая от
и
не
зависит. Но
и
равноправны,
значит левая часть не зависит также и
от
.
Значит, это константа.
,
значит и левая от
и
не
зависит. Но
и
равноправны,
значит левая часть не зависит также и
от
.
Значит, это константа.
![]()
![]()
![]()
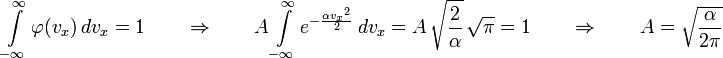
![]()
Теперь нужно сделать принципиальный шаг - ввести температуру. Кинетическое определение температуры (как меры средней кинетической энергии движения молекул):
![]()
где
![]() Дж/К
- постоянная
Больцмана.
Дж/К
- постоянная
Больцмана.
![]()
Все направления равноправны:
![]()
Чтобы
найти среднее значение
![]() ,
проинтегрируем её вместе с функцией
плотности вероятности от минус до плюс
бесконечности:
,
проинтегрируем её вместе с функцией
плотности вероятности от минус до плюс
бесконечности:
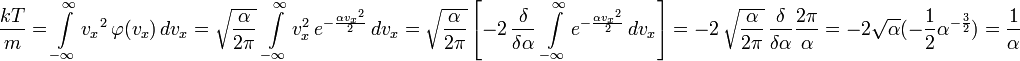
Отсюда
найдём
![]() :
:
![]()
Функция распределения плотности вероятности для (для и аналогично):
![]()
Рассмотрим
теперь распределение по величине
скорости. Вернемся в пространство
скоростных точек. Все точки с модулем
скорости
![]() лежат
в шаровом слое радиуса
и
толщины
лежат
в шаровом слое радиуса
и
толщины
![]() ,
и
-
объем этого шарового слоя.
,
и
-
объем этого шарового слоя.
![]()
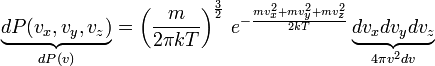
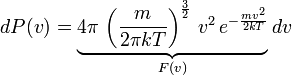
Так,
мы получили
![]() -
функцию плотности вероятности, которая
и называется распределением Максвелла.
-
функцию плотности вероятности, которая
и называется распределением Максвелла.
