
- •Физика конденсированного состояния вещества
- •Вводная глава
- •§1. Понятие пространства и времени.
- •§2.Масса, энергия, относительность
- •§3.Симметрия и асимметрия в неживой природе.
- •Глава I. Абстрактные группы
- •§1.Группа
- •§2.Сдвиг по группе
- •§3.Подгруппа
- •§4.Сопряжённые элементы и класс
- •§5.Инвариантная подгруппа
- •§6.Фактор – группа
- •§7. Изоморфизм и гомоморфизм групп
- •§8. Представления групп
- •§9. Характеры представлений
- •§10.Регулярное представление
- •§11. Примеры групп имеющих, приложение в физике
- •§12.Теория групп и квантовая механика
- •Глава II.Описание структуры кристаллов
- •§1.Общие свойства макроскопических тел
- •§2. Точечные группы.
- •§3. Симметрия кристаллов
- •§4.Сингонии.
- •§5.Неприводимые представления группы трансляций
- •§5.Конкретные примеры прямой и обратной решёток
- •1) Прямые решётки.
- •§6.Обозначения узлов, направлений и плоскостей в кристалле
- •§7.Определение структуры кристаллов.
- •§8. Атомный и геометрический структурный факторы
- •Глава III Движение электрона в периодическом поле
- •§1. Адиабатическое приближение
- •§2. Уравнения Хартри
- •§3 Уравнения Хартри-Фока
- •§4.Обменное взаимодействие
- •§5. Кристаллический потенциал и свойства симметрии гамильтониана
- •§6. Теорема Блоха
- •§7. Одноэлектронное уравнение Шрёдингера
- •§8. Приближение свободных электронов
- •§9. Плотность состояний
- •§10. Эффективная масса электронов
- •§11.Приближение почти свободных электронов
- •§12.Метод сильной связи
- •§13. Поверхность Ферми
- •§14. Химический потенциал и физическая статистика
- •Глава IV. Силы связи в кристаллах
- •§1. Силы Ван - дер – Ваальса
- •§2. Ионные кристаллы
- •§3.Ковалентная связь
- •§4. Металлическая связь
- •§5.Водородная связь.
- •Глава V. Динамика решётки.
- •§1. Силы упругости в кристаллах.
- •§2.Колебания и волны в одномерной атомной цепочке.
- •§3. Колебания и волны в двухатомной одномерной цепочке
- •§ 4.Нормальные колебания в трёхмерных кристаллах
- •§5. Понятие о фононах
- •§6.Спектр нормальных колебаний решётки.
- •§7.Теплоёмкость твёрдого тела
- •§8.Теплоёмкость электронного газа
- •Глава VI. Физика полупроводников
- •§1.Собственные полупроводники
- •§2. Примесные полупроводники
- •§3.Статистика электронов и дырок в полупроводниках
- •§4.Положение уровня Ферми и концентрация носителей в собственных полупроводниках
- •§5. Положение уровня Ферми и концентрация носителей в примесных полупроводниках.
- •Глава VII Кинетические свойства твёрдых тел
- •§1. Электропроводность
- •§2. Вычисление времени релаксации
- •§3. Кинетическое уравнение Больцмана
- •§4.Статическая проводимость
- •§5. Классическая теория электропроводности в магнитном поле
- •Глава VIII Растворы и химические соединения Введение
- •§1. Фазовая диаграмма.
- •§2. Упорядоченные растворы.
- •§3.Фазовые превращения.
- •§4. Типы фазовых диаграмм.
- •§5. Системы с образованием химических соединений
- •§6. Сплавы типа растворов внедрения.
- •§7. Упорядочение в сплавах
- •§8. Электронное строение сплавов и неупорядоченных систем
- •§9. Ближний порядок в сплавах
- •§10. Статистическая теория ближнего порядка
- •§11. Факторы, обусловливающие ближний порядок
- •Глава IX.Строение жидкостей и аморфных тел
- •§1. Особенности твёрдого, жидкого и газообразного состояний вещества
- •§2. Радиальные функции распределения межатомных расстояний и атомной плотности
- •§3. Функции распределения в статистической физике
- •§4.Уравнение для бинарной функции распределения
- •§5. Решение уравнения для бинарной функции распределения
- •§6.Уравнение Перкуса – Йевика
- •Глава X.Элементы физики жидких кристаллов Введение
- •§1.Классификация жидких кристаллов
- •2.Смектики c.
- •Смектики b.
- •Заключение. Фуллерены. Углеродные нити
§2. Ионные кристаллы
Химическая неактивность инертных газов обусловлена тем, что внешняя электронная структура их атомов, состоящая из восьми электронов, целиком, заполняющих ns– и np– подоболочки, является весьма стабильной конфигурацией. Атомы, стоящие в периодической таблице рядом с инертпыми газами, обладают склонностью принимать их конфигурацию путём отдачи или принятия электронов. У атомов щелочных металлов, стоящих непосредственно за инертными газами, валентный электрон движется вне заполненого слоя и связан с ядром слабо.
У галоидов,
стоящих непосредственно перед инертными
газами, недостаёт одного электрона
для заполненния устойчивого слоя
благородного газа. Поэтому они обладают
высоким сродством к дополнительному
электрону. Они будут иметь электронную
структуру подобную инертным газам,
если соответствующие атомы отдадут
или примут несколько электронов.
Например, в ионных соединениях![]() и
и
![]() ионы
ионы![]() и
и
![]() имеют электронную конфигурацию неона,
а ионы
имеют электронную конфигурацию неона,
а ионы
![]() и
и
![]() –
электронную конфигурацию аргона. Ионная
связь (её также называют полярной,
гетерополярной или электровалентной)
в таких соединениях является результатом
электростатического притяжения
разноимённо заряженных ионов. При
достаточно тесном сближении ионов их
внутренние оболочки приходят в
соприкосновение, однако взаимного
проникновения этих оболочек не происходит
вследствие принципа Паули. В связи с
этм возникают силы отталкивания. Связь
между слами притяжения и отталкивания
и энергией решётки
была установлена Борном и Майером в
следующем виде
–
электронную конфигурацию аргона. Ионная
связь (её также называют полярной,
гетерополярной или электровалентной)
в таких соединениях является результатом
электростатического притяжения
разноимённо заряженных ионов. При
достаточно тесном сближении ионов их
внутренние оболочки приходят в
соприкосновение, однако взаимного
проникновения этих оболочек не происходит
вследствие принципа Паули. В связи с
этм возникают силы отталкивания. Связь
между слами притяжения и отталкивания
и энергией решётки
была установлена Борном и Майером в
следующем виде
![]() ,
,
где e–заряд электрона, d– расстояние между ионами, величина A – известна под названием постоянной Маделунга и определяется кристаллической структурой соединения. Второй член этого выражения является эмпирическим: он описывает отталкивание между ионами. Кристаллическая структура, свойственная ионным соединениям в значительной степени зависит от относитедльных размеров двух ионов В структуре ионы значительно отличаются по размерам, причём, как видно из рис. а, каждый ион натрия окружён шестью ионами хлора и в свою очередь каждый ион хлора окружён шестью ионами натрия. У соединения CsCl, оба типа ионов которого имеют близкие размеры, решётка построена таким образом, что каждый ион хлора окружён восемью ионами цезия и наоборот – рис. б.
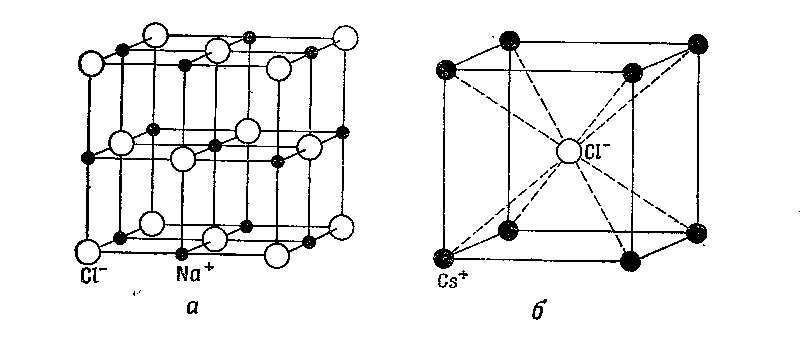
Эти примеры показывают, что яисло ближайших соседей в ионных кристаллах, не является характеристикой данного типа связи. Как правило, кристаллы с преимущественно ионнымр связями отличаются высокой температурой плавления, прочностью и твёрдостью и низким коэффициентом термического расширения. Они также обладают высокопрочной межатомной связью. Поскольку все электроны в ионных кристаллах сосредоточены на орбиталях отдельных атомов, они не могут принимать участие в проводимости, и в связи сэтим ионные кристаллы являются изоляторами.
§3.Ковалентная связь
Стабильный
(ns+np)–октет
электронов, характерный для инертных
газов, можно получить также путём
обобществления электронов, принадлежащих
разным атомам. Например, у атома хлора
не хватает всего одного электрона для
образования стабильной конфигурации
типа аргона. Следовательно, два атома
хлора моеут поделить между собой два
электрона,образуя молекулу хлора![]() .Диаграмму
этого объединения можно представить в
таком виде
.Диаграмму
этого объединения можно представить в
таком виде
![]()
Такая связь между двумя атомами известна под названием единичной ковалентной или гомеополярной. Эти два обобществлённых электрона должны иметь противоположно направденные спины, а ковалентную связь можно представить как обменное взаимодействие электронов, принадлежащих двум атомам, в результате которого возникает эффект резонанса, т.е. электроны принадлежат обоим атомам и не связаны ни с одним их них. В общем случае число единичных ковалентных связей, которые может образовать данный атом, равно числу электронов, необходимых для заполнения (ns+np) – подоболочек. Элементы, имеющие N электронов на уровнях (ns+np), будут принадлежать к N–ой группе периодической системы и, следовательно, могут принять участие в образовании (8-N) единичных ковалентных связей. Ковалентная связь характеризуется явно выраженным свойством направленности. Так в кристаллах углерода, германия и кремния в решётке алмаза каждый атом пмещается в центре тетраэдра, образованного четырьмя атомами, являющимися его ближайшими соседями. Связь осуществляется электронами на гибридных sp – орбиталях, направленных к вершинам правильного тетраэдра. Кроме того, имеет свойство насыщаемости,– оно заключается в том, что каждый атом способен образовать связь, лишь с определённым числом соседей. Кристаллы с ковалентной связью отличаются высокими температурами плавления, высокой прочностью и твёрдостью. При этом они, подобно ионным кристаллам являются изоляторами, но с более узкой запрещённой щелью.
