
- •Физика конденсированного состояния вещества
- •Вводная глава
- •§1. Понятие пространства и времени.
- •§2.Масса, энергия, относительность
- •§3.Симметрия и асимметрия в неживой природе.
- •Глава I. Абстрактные группы
- •§1.Группа
- •§2.Сдвиг по группе
- •§3.Подгруппа
- •§4.Сопряжённые элементы и класс
- •§5.Инвариантная подгруппа
- •§6.Фактор – группа
- •§7. Изоморфизм и гомоморфизм групп
- •§8. Представления групп
- •§9. Характеры представлений
- •§10.Регулярное представление
- •§11. Примеры групп имеющих, приложение в физике
- •§12.Теория групп и квантовая механика
- •Глава II.Описание структуры кристаллов
- •§1.Общие свойства макроскопических тел
- •§2. Точечные группы.
- •§3. Симметрия кристаллов
- •§4.Сингонии.
- •§5.Неприводимые представления группы трансляций
- •§5.Конкретные примеры прямой и обратной решёток
- •1) Прямые решётки.
- •§6.Обозначения узлов, направлений и плоскостей в кристалле
- •§7.Определение структуры кристаллов.
- •§8. Атомный и геометрический структурный факторы
- •Глава III Движение электрона в периодическом поле
- •§1. Адиабатическое приближение
- •§2. Уравнения Хартри
- •§3 Уравнения Хартри-Фока
- •§4.Обменное взаимодействие
- •§5. Кристаллический потенциал и свойства симметрии гамильтониана
- •§6. Теорема Блоха
- •§7. Одноэлектронное уравнение Шрёдингера
- •§8. Приближение свободных электронов
- •§9. Плотность состояний
- •§10. Эффективная масса электронов
- •§11.Приближение почти свободных электронов
- •§12.Метод сильной связи
- •§13. Поверхность Ферми
- •§14. Химический потенциал и физическая статистика
- •Глава IV. Силы связи в кристаллах
- •§1. Силы Ван - дер – Ваальса
- •§2. Ионные кристаллы
- •§3.Ковалентная связь
- •§4. Металлическая связь
- •§5.Водородная связь.
- •Глава V. Динамика решётки.
- •§1. Силы упругости в кристаллах.
- •§2.Колебания и волны в одномерной атомной цепочке.
- •§3. Колебания и волны в двухатомной одномерной цепочке
- •§ 4.Нормальные колебания в трёхмерных кристаллах
- •§5. Понятие о фононах
- •§6.Спектр нормальных колебаний решётки.
- •§7.Теплоёмкость твёрдого тела
- •§8.Теплоёмкость электронного газа
- •Глава VI. Физика полупроводников
- •§1.Собственные полупроводники
- •§2. Примесные полупроводники
- •§3.Статистика электронов и дырок в полупроводниках
- •§4.Положение уровня Ферми и концентрация носителей в собственных полупроводниках
- •§5. Положение уровня Ферми и концентрация носителей в примесных полупроводниках.
- •Глава VII Кинетические свойства твёрдых тел
- •§1. Электропроводность
- •§2. Вычисление времени релаксации
- •§3. Кинетическое уравнение Больцмана
- •§4.Статическая проводимость
- •§5. Классическая теория электропроводности в магнитном поле
- •Глава VIII Растворы и химические соединения Введение
- •§1. Фазовая диаграмма.
- •§2. Упорядоченные растворы.
- •§3.Фазовые превращения.
- •§4. Типы фазовых диаграмм.
- •§5. Системы с образованием химических соединений
- •§6. Сплавы типа растворов внедрения.
- •§7. Упорядочение в сплавах
- •§8. Электронное строение сплавов и неупорядоченных систем
- •§9. Ближний порядок в сплавах
- •§10. Статистическая теория ближнего порядка
- •§11. Факторы, обусловливающие ближний порядок
- •Глава IX.Строение жидкостей и аморфных тел
- •§1. Особенности твёрдого, жидкого и газообразного состояний вещества
- •§2. Радиальные функции распределения межатомных расстояний и атомной плотности
- •§3. Функции распределения в статистической физике
- •§4.Уравнение для бинарной функции распределения
- •§5. Решение уравнения для бинарной функции распределения
- •§6.Уравнение Перкуса – Йевика
- •Глава X.Элементы физики жидких кристаллов Введение
- •§1.Классификация жидких кристаллов
- •2.Смектики c.
- •Смектики b.
- •Заключение. Фуллерены. Углеродные нити
Глава IV. Силы связи в кристаллах
Теория энергетических зон, изложенная в предыдущих параграфах, составляет основу современной трактовки физических свойств твёрдых материалов, и в этой области ведутся многочисленные исследования как теоретические, так и экспериментальные.
Ещё до этого периода исследования был установлен ряд общих черт зонной структуры и выяснена их связь с некоторыми характерными качественными различиями между кристаллами. Среди твёрдых тел можно выделить определённые большие классы веществ, и существоание этих классов легко объяснить исходя из характеристик их зонной структуры. Одной из отличительных особенностей кристаллов определённого класса является природа сил, действующих между атомами (или ионами) в твёрдом теле.
Не существует, разумеется, какого – либо универсального способа классификации различных твёрдых тел, поскольку принципг группировки зависит как от рассматриваемой конкретной проблемы, так и от точки зрения того, кто производит классификацию. В настоящем конспекте мы будем исходить из характера сил, связывающих между собой атомы или ионы в твёрдом теле. Для возникновения устойчивой структуры твёрдого тела необходимо, чтобы между частицами действовали двоякого рода силы: силы притяжения, препятствующие удалению частиц друг от друга, и силы отталкивания, не позволяющие частицам слиться друг с другом.
§1. Силы Ван - дер – Ваальса
Все атомы, ионы и молекулы испытывают слабое взаимное притяжение друг к другу, котоое обусловлено стлами Ван – дер – Ваальса, однако в большинстве кристаллов эти силы очень малы по сравнению с другими силами. Такие связи встречаются у тех элементов и соединений, в которых электронная конфигурация лишь в малой степени допускает переходы электронов между атомами. Вандерваальсово притяжение является единственной силой между атомами с заполненными электронными оболочками (как это имеет место в случае инертных газов), когда нет перекрытия волновых функций электронов. Эти силы обусловлены взаимной поляризацией атомов при сближении иих друг с другом.
Поляризация создающая эти связи, обусловлена координировнным движением электронов в электронных оболочках соседних атомов. Электроны каждого из атомов смещаются относительно ядра в присутствии другого атома, т.е. атом превращается в диполь. Эта поляризация по своему характеру такова, что спообствует уменьшению энергии, и поэтому диполи притягивают друг друга и это притяжение способствует спонтанной кристаллизации. На рис эта ситуация представлена для гелия
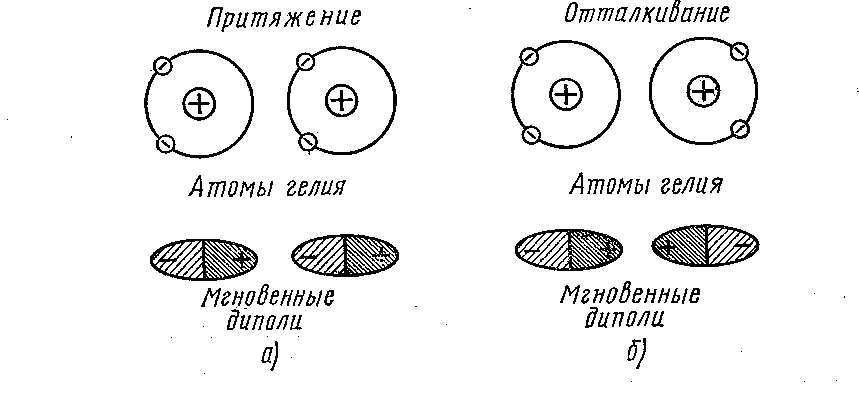
Поскольку силы Ван–дер–Ваальса слабы, то обусловленная ими энергия связи невелика и составляет несколько тысяч калорий на моль. Типичные значения этой энергии приведены в таблице.
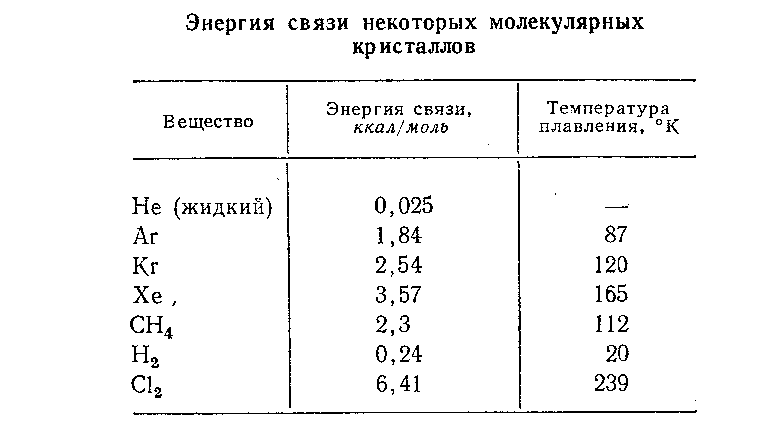
В этой таблице не совсем правомерно приведена энергия связи жидкого гелия; она столь мала, что гелий не может образовать кристалл даже в случае самых низких достижимых сейчас температур. Этот факт даёт основание предсказать, что гелий остаётся жидким даже при абсолютном нуле температур.
Физические свойства кристаллов с чисто вандерваальсовыми связями очень просты; по электрическим свойствам они изоляторы с широкой запрещённой зоной. Они прозрачны для электромагнитого излучения вплоть до области дальнего ультрафиолета.
