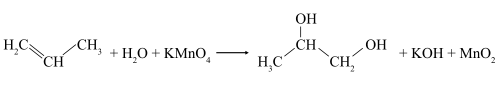- •Непредельные одноосновные карбоновые кислоты
- •Химические свойства диазосоединений
- •Полимеризация
- •Окисление кислородом воздуха в пропиленоксид
- •I. По происхождению высокомолекулярные соединения подразделяют на:
- •II. По природе высокомолекулярные соединения подразделяются на:
- •III. По типу реакций получения высокомолекулярные соединения делятся на:
- •IV. По отношению к действию повышенных температур высокомолекулярные соединения подразделяют на:
- •V. В зависимости от состава основной (главной) цепи высокомолекулярные соединения делят на два больших класса:
- •VI. По структуре макромолекул высокомолекулярные соединения могут подразделяться на:
61 Количество атомов лежат в одной плоскости молекулы толуола
6 Атомом углерода располагаются в одной плоскости (цикл имеет плоское строение).

62 Понятие непредельные и ароматические к.к.
Карбо́новые кисло́ты — класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп -COOH.
Непредельные одноосновные карбоновые кислоты
Непредельные одноосновные кислоты этиленового ряда имеют общую формулу CnH2n-1COOH, ацетиленового и диэтиленового рядов - CnH2n-3COOH. Примеры непредельных одноосновных кислот:
|
|
|
|
CH2=CHCOOH |
акриловая кислота, пропеновая кислота |
|
|
CH2=CHCH2COOH |
винилуксусная кислота, 3-бутеновая кислота |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Наиболее простые ненасыщенные двухосновные кислоты - фумаровая и малеиновая - имеют одну и ту же структурную формулу HOOCCH=CHCOOH, но разную пространственную конфигурацию. Обе кислоты способны образовывать соли, сложные эфиры, амиды и некоторые другие производные кислот. Однако, малеиновая кислота, в отличие от фумаровой, легко образует циклический ангидрид, так как обе карбоксильные группы расположены по одну сторону от двойной связи (цис-изомер). Малеиновый ангидрид служит характерным реактивом для обнаружения 1,3-диеновых соединений: он легко вступает в реакцию диенового синтеза и во многих случаях дает ценные продукты. Малеиновый ангидрид широко применяется при производстве полиэфирных смол и сополимеров со стиролом, акриловым и метакриловым эфирами. Гидратацией малеинового ангидрида получают яблочную кислоту, применяемую в пищевой промышленности.
Ароматическими карбоновыми кислотами называются производные бензола, содержащие карбоксильные группы, непосредственно связанные с ароматическим ядром. Кислоты, содержащие карбоксильные группы в боковой цепи, рассматриваются как жирноароматические. По количеству карбокисльных групп ароматические кислоты делятся на одно-, двухосновные и т.д. Название кислоты производится от ароматического углеводорода (бензойная кислота, п-толуиловая кислота).
63 Диазосоединения
Диазосоединения — ароматические соединения общей формулы R—N+≡NX−, где R — арильный радикал; содержит группировку из двух атомов азота, связанную только с одним арильным радикалом. X представляет кислотный остаток или гидроксогруппу (Cl−, NO3−, ОН− и др.), например, хлористый диазобензол C6H5N≡NCl. Диазосоединения получают диазотированием аминов. Диазосоединения применяется для самых разнообразных синтезов, для получения азокрасителей, лекарственных веществ.
Химические свойства диазосоединений
Диазосоединения химически очень активны. Наиболее важны их реакции, идущие с выделением азота. При нагревании растворов арендиазония (как правило процесс ведут в 40-50 % растворе серной кислоты) диазогруппа замещается гидроксилом:
ArN≡NX+H2O→ArOH+N2+HX
Замещение диазогруппы на фтор происходит при нагревания сухого тетрафторбората арендиазония
ArN≡NBF4→ArF+N2+BF3.
В водном растворе диазогруппу можно заменить на хлор, бром, нитро- и цианогруппу действием солей одновалентной меди в присутствии соответствующих кислот (реакция Зандмейера):
ArN≡NX+CuCl→ArCl+N2+CuX
ArN≡NX+CuCN→ArCN+N2+CuX
Замещение на иод и тиоцианат,Идет по ионно-радикальному механизму даже в обычных условиях:
ArN≡NX+I−→ArI+N2+X−
ArN≡NX+SCN−→ArSCN+N2+X−
Без катализатора диазогруппа заменяется на азидную и сульфгидридную
64 Химические св-ва алкенов на примере пропена
Химические свойства
Присоединение галогенов (галогенирование)
Реакцию галогенирования обычно проводят в растворителе при обычной температуре. Галогены легко присоединяются по месту разрыва двойной связи с образованием дигалогенопроизводных. Легче идет присоединение хлора и брома, труднее — йода. Фтор взаимодействует со взрывом.

Присоединение водорода (реакция гидрирования)

Присоединяя водород в присутствии катализаторов (Pt, Pd, Ni), пропен переходит в предельный углеводород — пропан.
Присоединение воды (реакция гидратации)

Пропилен реагирует с водой с образованием одноатомного спирта изопропанола, при этом двойная связь раскрывается.
Присоединение галогеноводородов (HHal)
Происходит по правилу Марковникова. Водород кислоты HHal присоединяется к наиболее гидрированному атому углерода при двойной связи. Соответственно остаток Hal связывается с атомом углерода, при котором находится меньшее число атомов водорода.
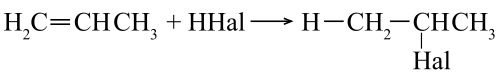

Пример гидрогалогенирования — получение бромпроизводного пропана при реакции бромоводорода и пропилена.
Горение на воздухе
При поджигании горит на воздухе: 2СН2=СНСН3 + 9О2 → 6СО2 + 6Н2О.
С кислородом воздуха газообразный пропилен образует взрывчатые смеси.
В слабощелочной или нейтральной водной среде пропилен окисляется перманганатом калия, что сопровождается обесцвечиванием раствора KMnO4 и образованием гликолей (соединений с двумя гидроксильными группами при соседних атомах углерода). Эта реакция получила название реакции Вагнера.