
Молекулярка
Вопрос 1.
Идеальный газ — математическая модель газа, в которой предполагается, что потенциальной энергией взаимодействия молекул можно пренебречь по сравнению с их кинетической энергией. Между молекулами не действуют силы притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Основными величинами, характеризующими поведение и свойства газа, являются объём V, давление Р и температура Т.
Средняя кинетическая энергия
характеризуется физической величиной,
называемой температурой. Поэтому говорят
о постоянстве температуры или
изменении температуры, а не о средней
энергии. Их связь определяется в
виде:
![]() ,
где k = 1,38.10-23 Дж/К - постоянная Больцмана.
Температура Т является термодинамической
температурой, связанной с температурой
Цельсия: Т = t + 273,15.
,
где k = 1,38.10-23 Дж/К - постоянная Больцмана.
Температура Т является термодинамической
температурой, связанной с температурой
Цельсия: Т = t + 273,15.
![]()


Вопрос 2.

Число степеней свободы - число независимых переменных, которыми определяется состояние системы. В условиях статистического равновесия на каждую степень свободы системы приходится одинаковая средняя энергия
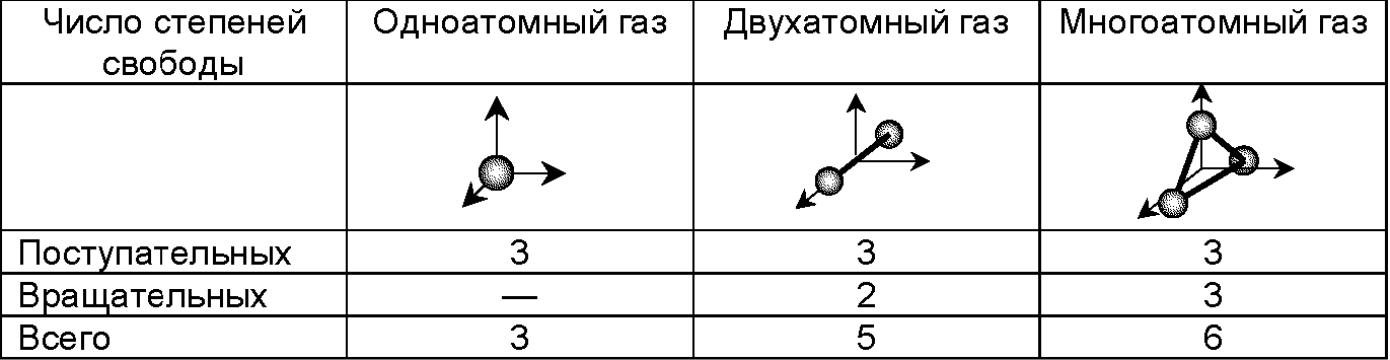
Закон о равнораспределении энергии по степеням свободы : На каждую молекулу идеального газа в среднем приходится одинаковая кинетическая энернгия равная 1/2кт, а на колебательную степень свободы приходится потанциальная энергия ½ кт.
Вопрос 3.
Давление с точки зрения молекулярно-кинетической теории — это среднее значение импульса, переданное молекулами газа при столкновениях со стенкой сосуда каждой
единице ее площади за единицу времени. Основное уравнение МКТ:
![]() ,
где k является постоянной Больцмана
(отношение универсальной газовой
постоянной R к числу Авогадро NA), i —
число степеней свободы молекул (i = 3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура. Основное
уравнение МКТ связывает макроскопические
параметры (давление, объём, температура)
газовой системы с микроскопическими
(масса молекул, средняя скорость их
движения).
,
где k является постоянной Больцмана
(отношение универсальной газовой
постоянной R к числу Авогадро NA), i —
число степеней свободы молекул (i = 3 в
большинстве задач про идеальные газы,
где молекулы предполагаются сферами
малого радиуса, физическим аналогом
которых могут служить инертные газы),
а T - абсолютная температура. Основное
уравнение МКТ связывает макроскопические
параметры (давление, объём, температура)
газовой системы с микроскопическими
(масса молекул, средняя скорость их
движения).
Вопрос 4.
Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Клапейрона — Менделеева) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
![]()
где
— давление,
— молярный объём,
— универсальная газовая постоянная
— абсолютная температура,К.
Так как
![]() ,
где
,
где
![]() —
количество вещества, а
—
количество вещества, а
![]() ,
где
,
где
![]() — масса,
— масса,
![]() — молярная масса, уравнение состояния
можно записать:
— молярная масса, уравнение состояния
можно записать:![]()
Эта форма записи носит имя уравнения (закона) Менделеева — Клапейрона.
Вопрос 5.
Основа статистического метода — молекулярно-кинетическая теория. Кинетическая теория изучает свойства вещества, рассматривая их состоящими из атомов (молекул), находящихся в непрерывном хаотическом движении, интенсивность которого меняется с температурой. Цель теории такова: истолковать физические свойства веществ и описать тепловые явления, наблюдаемые в опыте, как результат суммарного действия
большого числа частиц (молекул или атомов). При этом применяется статистический метод, который основан на использовании лишь средних величин и не интересуется параметрами, характеризующими отдельную частицу. Этот подход позволяет описать наблюдаемые свойства вещества макроскопическими параметрами (Р, Т и т.д.) и выразить их через средние значения некоторых микроскопических величин, характеризующих отдельную молекулу. Фу́нкция распределе́ния в теории вероятностей — функция, характеризующая распределение случайной величины или случайного вектора.
