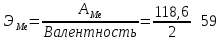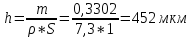Лаба 3
.docxФедеральное агентство железнодорожного транспорта
Федеральное государственное бюджетное образовательное учреждение
высшего образования «ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
ПУТЕЙ СООБЩЕНИЯ имени императора Александра I»
Кафедра «Инженерная химия и естествознание»
Дисциплина: «Современные защитные материалы»
Отчёт
По лабораторной работе №3
«Металлические покрытия»
Вариант №1
Выполнил студент
факультета ТЭС
группы ПТМ-613
Сызранов И.Ю.
Проверила
Масленникова Л.Л.
Санкт-Петербург
2018
Цель работы: ознакомление с методами защиты металлов от коррозии при помощи металлических защитных покрытий.
Основные теоретические положения:
Опыт 1
Никелирование медного электрода.
Ход работы:
Медный электрод очистить наждачной бумагой. Очищенный электрод опустить на 1-2 минуты в стаканчик с 15-20% раствором щёлочи, после чего промыть её водой из промывалки, держа за конец, к которому прикреплён провод. Не касаться руками электрода, так как жир, оставшийся на поверхности даже в ничтожных количествах, не даёт металлу прочно пристать к предмету. Обезжиренный электрод опустить на 1-2 минуты в 4Н раствор серной кислоты с целью освободить поверхность металла от оксидов. Снова обмыть электрод водой из промывалки и положить на кусочек фильтровальной бумаги.
В U-образную трубку налить заготовленный заранее электролит для никелирования и опустить в него медный и никелевый электрод. Соединить последние так, чтобы медный электрод был катодом, а никелевый – анодом. Через несколько минут наблюдать покрытие той части медного электрода, который был погружен в раствор электролита. Написать уравнения катодного и анодного процессов.
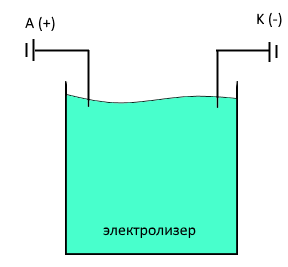
(+) A: Ni - 2e = Ni2+
(-) K: Ni2+ +2e = Ni
Вывод:
Ni2SO4
Опыт 2
Определение толщины слоя покрытия капельным методом.
Ход работы:
Из капельницы наносят на образец одну каплю раствора и по секундомеру отмечают время. По истечении одной минуты каплю снимают, промокая её фильтровальной бумагой, и на то же место наносят вторую каплю раствора. И так до тех пор, пока не обнаружится участок основного металла, равный по величине половине поверхности, занимаемой каплей. По общему числу капель определяют толщину слоя.
Раствор 200 грамм KI и 100 грамм I2 в одном литре воды
1 минута при 10’С растворяет цинк толщиной 0,78 мкм
При 15’C – 1,245 мкм
Вывод:
Толщина покрытия – 6 * 1,245 = 7,47 мкм
Опыт 3
Значение различных металлических покрытий в защите стали от коррозии.
Ход работы:
В две пробирки налить по 3-5 мл воды и в каждую добавить по 5 капель концентрированного раствора красной кровяной соли K3[Fe(CN)6] и по 5 капель 2Н раствора H2SO4. В одну из пробирок поместить пластинку оцинкованного железа, в другую – такую же пластинку белой жести. Перед погружением пластинок в раствор при необходимости сделать на их поверхности несколько глубоких царапин. Написать уравнения катодных и анодных процессов, объяснить изменение окраски металла на царапинах и в поведении защитных покрытий в случае нарушения их сплошности.
Красная кровяная соль – индикатор на ионы двухвалентного железа
а) Анодное покрытие (безопасное)
H++O2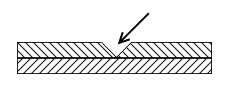
Zn (ϕ = -0,76 эВ)
A: Zn – 2e = Zn2+
Fe
(ϕ
=
-0,44 эВ)
б) Катодное покрытие (опасное)
H++O2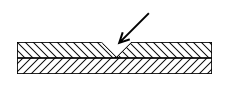
Sn
(ϕ
=
-0,14 эВ)
Fe
(ϕ
=
-0,44 эВ)
Вывод:
Олово (Sn, катодное покрытие) хорошо в тех случаях, когда сплошность не нарушается, в основном же применяется анодное, как более надёжное и устойчивое к потере сплошности.
Задача
Плотность катодного тока = 0,15 А/см2; время – 1 час; выход по току = 100% Плотность олова = 7,3 г/см3; 1мкм = 10-4 см