
- •Неорганическая химия
- •Оглавление
- •Введение
- •История открытия
- •Первый способ получения металлического цинка
- •Строение атома
- •3. Получение цинка
- •3.1. Промышленный способ
- •3.2. Лабораторный способ
- •4. Физические свойства металла
- •Физические свойства некоторых металлов
- •5. Химические свойства
- •5.1. Простое вещество
- •5.2. Амфотерность цинка
- •5.3. Соли цинка
- •5.4. Комплексные соединения
- •Константы нестойкости комплексных ионов [7, c . 334]
- •5.5. Нерастворимые соединения
- •Пр некоторых веществ [8, c. 383]
- •6. Биологическая роль цинка
- •6.1. Положительное влияние
- •6.2. Токсичность
- •Применение цинка
- •Заключение
- •Приложение 1
Первый способ получения металлического цинка
Получение металлического цинка было предложено английским ученым Уильямом Чемпионом в 1738 году дистилляционным (пирометаллургическим) способом в ретортах1[3, C. 204], который заключается в том, что цинковый концентрат подвергают обжигу (для получения оксида цинка), а затем восстанавливают коксом:
ZnO + C = Zn(пар)↑ +CO
после чего газообразный цинк конденсируется в на поверхности, откуда жидкий металл по мере наполнения вычерпывают. Однако этот способ дает не более 20% цинка в застывшей смеси металлов.
-
Строение атома
В периодической таблице Д. И. Менделеева цинк расположен в четвертого группе, в пятом ряду, IIB подгруппы. Его атом имеет 4s2 3d10конфигурацию внешнего электронного уровня. Последние десять электронов выполняют функцию экранирования, поэтому для цинка и его аналогов характерна степень окисления +2. Поскольку цинк является d-элементом, он, как и другие, может образовывать различные комплексные соединения. Магнитные и оптические свойства цинка как комплексообразователя можно определить, используя следующую диаграмму распределения электронов по d-έ и d-γ подуровням.
Рис. 2.1. Электронная конфигурация атома цинка.
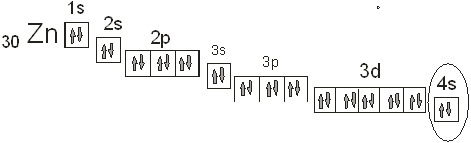

Рис. 2.2. расщепление d-подуровня Zn в тетраэдрическом поле лигандов.
Рассмотрев её, можно увидеть что, соединения цинка бесцветны, по причине того, что на всех d-подуровнях нет неспаренных электронов. По той же причине он обладает диамагнитными свойствами2. Координационное число цинка равняется 4, и поэтому подуровень d-γрасположен ниже, чем d-έ, следовательно, комплексные соединения цинка имеют форму тетраэдра. В комплексном ионе лиганды присоединяются к металлу на свободные 4s и 4p орбитали, образуя sp3 гибридизацию.
3. Получение цинка
3.1. Промышленный способ
Цинк, полученный пирометаллургическим способом[4], который был описан мною выше, подвергается рафинированию. Суть этого процесса заключается в том, чтобы уменьшить растворимость примесей путем охлаждения смеси до 430-450оС. После отстаивания чернового цинка в течении 24-36 часов, жидкий металл разделяется на три слоя: нижний содержит преимущественно свинец, второй кристаллы Fe и Zn, а третий очищенный цинк с примесями свинца и железа в количестве до 1%.
Существует и другой способ получения серебристого металла, путем гидрометаллургии, говоря более простым языком, путем электролиза. Данный метод имеет ряд преимуществ:
-
извлечение большего количества цинка и сопутствующих элементов;
-
большая комплексность использования сырья;
-
высокое качество цинка;
-
высокая механизация трудоемких процессов.
Суть этого способа заключается в следующем: цинк, обожженный до оксида, обрабатывают серной кислотой, для получения раствора сульфата цинка, данному процессу соответствует реакция:
ZnO + H2SO4 → ZnSO4 + H2O.
Однако следует заметить, что помимо необходимого цинка, по такой же схеме реагирует часть примесей. Раствор сульфата цинка очищают от ненужных веществ, после чего его отправляют на электролиз:
2ZnSO4 + 2H2O 2Zn↓ + H2SO4 + O2↑
K (-) Zn2+ + 2e-→ Zn0↓
A (+) 2H2O - 4e-→ 4H+ + O2↑.
Чистота цинка, выпадающего в осадок, напрямую зависит от чистоты раствора его сульфата. Полученный металл переплавляют в слитки. В Российской Федерации требования к цинку установлены в ГОСТ 3640-94 «Цинк, технические условия». Все отечественные марки цинка предусматривают чистоту металла не менее 97,5% [5, C.3].
