
- •Введение
- •Правила работы в химической лаборатории
- •Реактивы и правила обращения с реактивами
- •Реактивы общего пользования, в том числе реактивы, хранящиеся в вытяжном шкафу, не следует уносить к себе на рабочее место.
- •Меры предосторожности при работе в лаборатории
- •Оказание первой помощи
- •Лабораторный журнал и оформление лабораторных работ
- •Газовые законы и расчет молярных масс газообразных веществ
- •1. Уравнение Бойля-Мариотта и Гей-Люссака
- •5. Закон Дальтона (закон парциальных давлений).
- •Парциальное давление водяного пара в зависимости от температуры воздуха
- •II способ расчета:
- •Лабораторная работа №2 способы выражения содержания растворенного вещества в растворе
- •Раствор – гомогенная система состоящая из двух или нескольких компонентов. Чаще раствор состоит из двух компонентов растворителя и растворенного вещества.
- •Правило смешивания (правило «креста»)
- •Экспериментальная часть
- •Лабораторная работа № 3 определение энтальпии реакции нейтрализации
- •Значение термодинамических функций
- •Лабораторная работа №4 химическая кинетика
- •Закон действующих масс может быть записан
- •Закон действующих масс имеет вид
- •Лабораторная работа №5 химическое равновесие
- •Красный
- •Б/цв. Желтый синий
- •Лабораторная работа №6 определение молекулярной массы растворенного вещества методом криоскопии. (Глинка н.Л.,2000, 7.1-7.2, Коровин н.В.,2000, §8.1 )
- •Теоретические сведения
- •Лабораторная работа №7 коллоидные растворы
- •Выполнение работы:
- •3.1 Приготовление золя берлинской лазури при избытке FeCl3
- •3.2 Приготовление золя берлинской лазури при избытке k4[Fe(cn)6]
- •3.3 Определение знака заряда частиц золя
- •Лабораторная работа №8 свойства растворов электролитов
- •Все электролиты делят на сильные и слабые. Сильные электролиты
- •Слабые электролиты
- •Ионные реакции в растворе
- •Правила составления ионных уравнений реакций
- •Порядок составления ионных уравнений реакции
- •Условия необратимости реакций ионного обмена –
- •Ионное произведение воды
- •PH раствора
- •Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора
- •Гидролиз солей.
- •Отсутствие гидролиза в растворах.
- •Экспериментальная часть
- •2А) Получение осадков соли.
- •2Б) Получение амфотерного гидроксида и исследование его свойств.
- •Смещение равновесия гидролиза при изменении температуры
- •Лабораторная работа №9 определение общей жесткости воды методом комплексонометрического титрования
- •Теоретические сведения.
- •Лабораторная работа №10 Окислительно-восстановительные реакции
- •Расчет степени окисления
- •Окислительно-восстановительные свойства вещества и степени окисления входящих в него атомов
- •Составление уравнений окислительно-восстановительных реакций
- •Экспериментальная часть
- •Электрохимические процессы. Гальванический элемент
- •Экспериментальная часть
- •Лабораторная работа №12 коррозия металлов
- •Теоретические сведения
- •Экспериментальная часть
- •Турнбулева синь
- •Зависимость скорости коррозии железа от рН среды.
- •Лабораторная работа №13 электролиз водных растворов электролитов
- •Лабораторная работа №14 свинцовый аккумулятор
- •Зарядка
- •Разрядка:
- •Суммарная реакция в аккумуляторе:
- •Лабораторная работа №15 Исследование состава и некоторых свойств портландцемента.
Условия необратимости реакций ионного обмена –
это уменьшение концентрации иона в растворе при:
1. Образовании осадка () (смотри таблицу растворимости)
Pb(NO3)2 + 2KI PbI2 + 2KNO3
Pb2+ + 2I- PbI2
2. Выделении газа (
Na2CO3 + H2SO4 Na2SO4 + H2O + CO2
CO32- + 2H+ H2O + CO2
3. Образовании малодиссоциированного вещества (H2O)
Ca(OH)2 + 2HNO3 Ca(NO3)2 + 2H2O
H+ + OH- H2O
4. Образовании комплексных соединений (малодиссоциированныхкомплексных ионов)
CuSO4 • 5H2O + 4NH3 [Cu(NH3)4]SO4 + 5H2O
Cu2+ + 4NH3 [Cu(NH3)4]2+
В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, малодиссоциированных соединений (H2O) или комплексных ионов реакции обмена обратимы .
Ионное произведение воды
Вода является слабым электролитом и в незначительной степени диссоциирует на ионы по реакции:
H2O H+ + OH-
Установлено, что при 22ОС
KW = [H+][OH -] = 1 • 10-14 - (ионное произведение воды)
PH раствора
Величина pH (водородный показатель) используется для характеристики кислотности раствора. Если концентрация ионов водорода равна [H+], то
pH = -lg [H+]
pОH = -lg [ОH-]
рН + рОН = 14
В чистой воде [H+] = [OH-] = 10-7 и рН=7
В кислых растворах [H+] > [OH-] и pH < 7
В щелочных растворах [H+] < [OH-] и pH > 7
Методы измерения водородного показателя.
-
Колориметрический метод. Основан на способности некоторых органических соединений изменять свою окраску в зависимости от активности иона водорода
 в
растворе электролита. Эти соединения
называют кислотно-основными индикаторами
(см.табл).
в
растворе электролита. Эти соединения
называют кислотно-основными индикаторами
(см.табл).
Таблица
Изменение окраски кислотно-основных индикаторов в зависимости от pH раствора
|
Название |
Окраска индикатора в среде |
||
|
|
Кислая [H+] > [OH-] рН < 7 |
Нейтральная [H+] = [OH-] рН = 7 |
Щелочная [OH-] > [H+] рН > 7 |
|
Лакмус |
красный |
фиолетовый |
синий |
|
Фенолфталеин |
бесцветный |
бесцветный |
малиновый |
|
Метилоранж |
розовый |
оранжевый |
желтый |
Для более точного определения значения pH растворов используют сложную смесь нескольких индикаторов, нанесенную на фильтровальную бумагу (так называемый "Универсальный индикатор Кольтгоффа"). Полоску индикаторной бумаги обмакивают в исследуемый раствор, кладут на белую непромокаемую подложку и быстро сравнивают окраску полоски с эталонной шкалой для pH.
-
Электрохимический метод. Этот метод позволяет более точно определять значение рН среды. Он основан на измерении разности потенциалов двух электродов, помещенных в анализируемый раствор. Один из этих электродов – электрод сравнения – в процессе измерения имеет более постоянный потенциал, а потенциал второго электрода (обычно стеклянного) зависит от величины
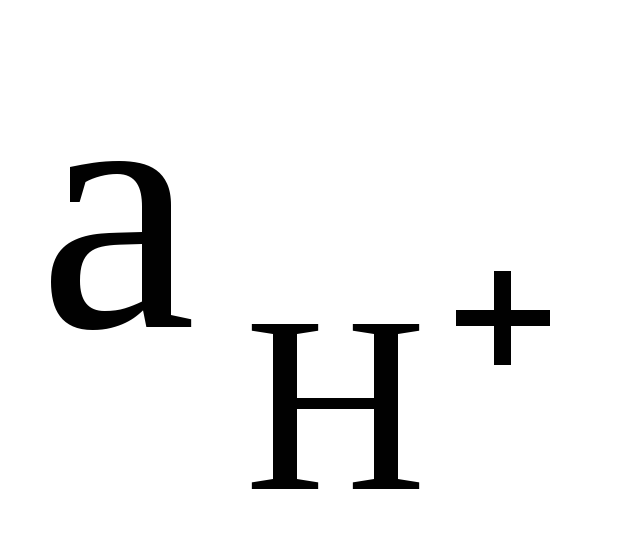 в анализируемом растворе. Потенциал
стеклянного электрода относительно
электрода сравнения измеряется
рН-метром, показывающая шкала которого
градуирована в единицах рН и позволяет
производить непосредственный отсчет
измеряемой величины. Электрохимический
метод определения водородного показателя
называют еще методом рН-метрии.
в анализируемом растворе. Потенциал
стеклянного электрода относительно
электрода сравнения измеряется
рН-метром, показывающая шкала которого
градуирована в единицах рН и позволяет
производить непосредственный отсчет
измеряемой величины. Электрохимический
метод определения водородного показателя
называют еще методом рН-метрии.
