
- •1.Дайте определение идеального и реального газа. Какой практический интерес представляет введение понятия идеального газа? (4,5)
- •16. Что такое кажущаяся (фиктивная) молекулярная масса смеси идеальных газов? Как она подсчитывается? (4)
- •27. Какова связь между истинной и средней теплоемкостями? Как вычисляется тепло в процессе через истинную и среднюю теплоемкости? (5)
- •Контрольная работа 2 (первая часть курса Задачи
- •Контрольная работа 3 (первая часть курса) Задачи
- •Дано: Найти:
- •Контрольная работа 5 (вторая часть курса) Задачи
- •16. Изобразите индикаторные диаграммы четырёхтактного и двухтактного двигателей со сжиганием топлива при постоянном объёме и постройте в pv- диаграмме соответствующий им идеальный цикл. (4)
- •Контрольная работа 6 (вторая часть курса)
27. Какова связь между истинной и средней теплоемкостями? Как вычисляется тепло в процессе через истинную и среднюю теплоемкости? (5)
Теплоемкость в данной точке, т.е. на бесконечно малом участке рассматриваемого термодинамического процесса х = const изменения состояния системы называется истинной. Она обозначается с соблюдением всех вышеизложенных правил с помощью буквы «с».
В
практике приходится иметь дело с
конечными процессами, когда изменение
температуры ТС изменяется от значения
t1
до значения t2.
В этом случае удобно использовать
понятие средней
теплоемкости вещества в процессе х
= const в
интервале температур t1—t2.
Указанная теплоемкость обозначается
следующим образом:
![]() .
С ее помощью удельная теплота процесса
на участке с начальной температурой t1
и конечной температурой t2
определяется:
.
С ее помощью удельная теплота процесса
на участке с начальной температурой t1
и конечной температурой t2
определяется:
![]() ,
,
где
![]() -
средняя удельная теплоемкость ТС в
рассматриваемом процессе х=const
на участке с начальной температурой t1
и конечной температурой t2.
-
средняя удельная теплоемкость ТС в
рассматриваемом процессе х=const
на участке с начальной температурой t1
и конечной температурой t2.
Из данного соотношения очевидно определение средней теплоемкости ТС в том или ином процессе х = const. в интервале температур t1—t2
![]()
Взаимосвязь средней и истинной теплоемкости:
![]() =
=
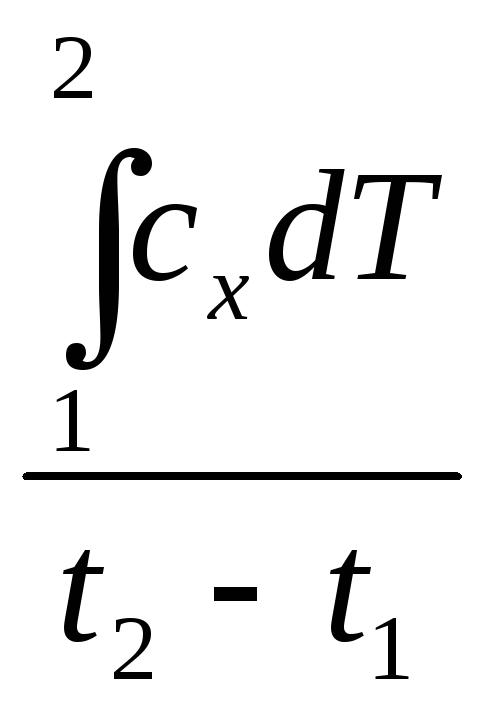 ;
;
![]() =
=
![]() .
.
С помощью истинной теплоемкости теплота процесса 1-2 определяется:
q=![]() ,
,
где
![]() -
истинной теплоемкости теплота процесса
1-2.
-
истинной теплоемкости теплота процесса
1-2.
Из данного соотношения очевидно определение истинной теплоемкости:
![]() =
=![]() .
.
Контрольная работа 2 (первая часть курса Задачи
1. 4 кг воздуха расширяются изотермически при температуре t=50° С так, что его объем возрастает в 3,5 раза, а давление становится равным p=0,1 МПа. Определить начальный я и конечный объемы газа, количество подводимого к нему тепла и изменение его энтропии.
Дано: Найти:
m(возд)=4 кг; V1=?;
t=50˚C; V2=?;
V2=3.5V1; q1=?;
p2=0.1 МПа; ∆S=?;
T=const;
-
P1=0.1 МПа
t1=50˚C
V1
p2=0.1 МПа
t2=50˚C
V2
Рис.1

Решние:
Т.к. изотермическое расширение воздуха ,то используем закон Бойля-Мариотта:
pV=const
,при T=const![]() p1V1=
p2V2
(2) .Учитывая
,что V2=3.5V1,получаем:
p1V1=
p2V2
(2) .Учитывая
,что V2=3.5V1,получаем:
p1V1=
p2V1*3.5![]() p1=
3.5p2;
p1=0.35
МПа;
p1=
3.5p2;
p1=0.35
МПа;
Воспользуемся уравнением Менделеева-Клапейрона: pV=mRT/M. (1)
Для начального состояния воздуха:
p1V1=mRT1/M,где p1- давление воздуха в начальном состоянии; m- масса воздуха ; T-температура воздуха. Найдем объем воздуха в начальном состоянии:
V1= mRT/ p1M =4*8314*323/0.35*106*28.9=1.06 (м3).
Для конечного состояния воздуха:
p1V1=mRT1/M,где p1- давление воздуха в конечном состоянии; m- масса воздуха ; T-температура воздуха. Найдем объем воздуха в конечном состоянии:
V2= mRT/ p2M =4*8314*323/0.1*106*28.9=3.71 (м3).
Изменение энтропии вычисляем по формуле:
∆S=R*ln(p2/ p1)/M=8314*ln(0.35/0.1)/28.9=360.4 (Дж); (1)
Считаем количество подведенного тепла:
q1=∆S*T=360.4*323=116409 (Дж). (1)
Ответ: V1=1.06 (м3); V2=3.71 (м3); ∆S=360.4 (Дж); q1=116409 (Дж).
16. В процессе политропного сжатия кислорода затрачивается работа L=400 кДж, причем в одном случае от кислорода отводится 600 кДж, а в другом—кислороду сообщается 100 кДж тепла. Определить показатели обеих политроп. Процессы изобразить в pv- н Ts-диаграммах.
Дано: Найти:
L=-400 кДж; na =?;
a) Q1=100 кДж; nв =?;
b) Q2=-600 кДж;
Газ-кислород О2;
|
О2 |
|
О2 |

Рис.1

(2)
Для случая (а)-области I-III и VIII;для случая (b)-области IV-VII.
-
Характеристика молекулы идеального газа
Показатель адиабаты, k
Теплоемкость газов, кДж/(кмольК)
сv,
сp,
Одноатомная
1,67
12,56
20,93
Двухатомная
1,4
20,93
29,31
Многоатомная
1,33
29,31
37,68
(4)
Решение:
Кислород- двухатомный газ ,следовательно для него принимаем показатель адиабаты k=1.4.
Удельная молярная теплоемкость:cv,M=20.93 кДж/(кмольК) (см.табл.выше).
Удельная массовая теплоемкость:cv= cv,M/M (1);cv =20.8/32=0.65 кДж/(кгК).
Газовая постоянная для кислорода: RO2=R/MO2=0.26 кДж/(кгК) (1) ;
a) Подводимое тепло:
Q1=cv(T2-T1)(na-k)/(na-1); (2)
где Q1-подводимое тепло; T2 и T1-конечная и начальная температуры;
na-показатель политропы для случая а)
Выражение для затраченной работы:
![]() L=RO2(T1-T2)na/(
na-1);
(2)
L=RO2(T1-T2)na/(
na-1);
(2)
где L-затрачиваемая работа;
![]()
Q1/L= [cv(T1-T2)(k-na)/(na-1)]/ [RO2(T1-T2)na/( na-1)];
Q1/L=
cv(k-na)/naRO2![]()
![]() na=
cvkL/(Lcv+Q1
RO2)=0.65*1.4*{-400}/({-400}*0.65+100*0.26)=1.5.
na=
cvkL/(Lcv+Q1
RO2)=0.65*1.4*{-400}/({-400}*0.65+100*0.26)=1.5.
b) Отводимое тепло:
Q2=cv(T2-T1)(nb-k)/(nb-1);
где Q2-отводимое тепло; T2 и T1-конечная и начальная температуры;
nb-показатель политропы для случая b);
Выражение для затраченной работы:
![]() L=RO2(T1-T2)nb/(
nb-1);
L=RO2(T1-T2)nb/(
nb-1);
где L- затрачиваемая работа;
![]()
Q2/L= [cv(T1-T2)(k-nb)/(nb-1)]/ [RO2(T1-T2)nb/( nb-1)];
Q2/L=
cv(k-nb)/nbRO2![]()
![]() nb=
cvkL/(Lcv+Q2
RO2)=0.65*1.4*{-400}/({-400}*0.65+600*0.26)=0.8.
nb=
cvkL/(Lcv+Q2
RO2)=0.65*1.4*{-400}/({-400}*0.65+600*0.26)=0.8.
Ответ: na=1.5; nb=0.8.
27.
Используя дифференциальное уравнение
![]() вывести зависимость энтальпии от
температуры и удельного объема для
реального газа, подчиняющегося уравнению
состояния
вывести зависимость энтальпии от
температуры и удельного объема для
реального газа, подчиняющегося уравнению
состояния
Ван-дер-Ваальса
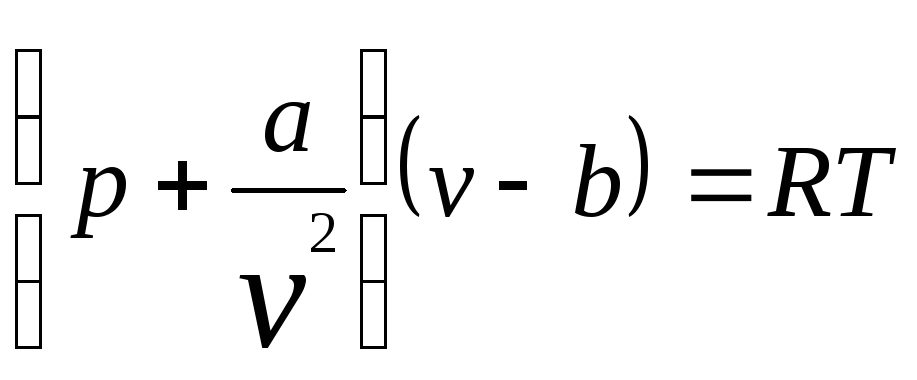 Определить
для 1 кг водяного пара энтальпию при
t=200° С и
Определить
для 1 кг водяного пара энтальпию при
t=200° С и
v =0,2 м3/кг, если a=1700 Нм4/кг2, b=0.169 10 -2 м3/кг (теплоемкость cv для Н20 взять при заданной температуре из табл. 5 приложения).
Дано: Найти:
m= 1 кг; i=?
t=200° С;
v =0,2 м3/кг;
a=1700 Нм4/кг2;
b=0.169 10 -2 м3/кг;
Решение:
Находим значение
производной
![]() из уравнения Ван-дер-Ваальса
:
из уравнения Ван-дер-Ваальса
:
![]()
![]()
![]() =
=![]() .
.
В выражение
![]() подставляем
значение производной
подставляем
значение производной
![]() :
:
![]() =
=![]() -
-![]() .
Заменив
.
Заменив
![]() на
на
![]() ,
получаем:
,
получаем:
![]() =
=![]() .
.
Проинтегрировав полученное выражение, получаем:
![]() ,
где
,
где
![]() производная
функция от температуры.
производная
функция от температуры.
Если V![]() ,
то реальный газ по свойствам стремиться
к идеальному, но для него
,
то реальный газ по свойствам стремиться
к идеальному, но для него
![]() .
Поэтому
.
Поэтому
![]() и
и
![]() .
.
Учитывая,
что
![]() ,
а
,
а
![]() ,
находим
,
находим
![]() .
.
Подставляем значения из условия задачи:
![]()
![]() 898.6
(кДж/кг).
898.6
(кДж/кг).
Ответ: i= 898.6 (кДж/кг).
