
- •Государственное образовательное учреждение высшего профессионального образования
- •Задание №1 по теме "строение вещества"
- •Варианты домашнего задания по теме «Строение вещества»
- •1.Задание по теме «строение атома»
- •ЗаданиЯ по теме «ковалентная химическая связь и строение молекулярных частиц»
- •2.1.Опишите строение предложенных в варианте задания молекул и молекулярных ионов по методу валентных связей (мвс):
- •Типы межмолекулярного взаимодействия
- •Список рекомендуемой литературы
- •Задание №2 по теме: «термохимия. Направление химических реакций»
- •Примеры решения задач
- •Вычисление стандартных теплот образования веществ и тепловых эффектов химических реакций
- •2. Рекомендации для самостоятельной работы студентов и варианты заданий
- •3. Задачи для самостоятельного решения
- •4. Варианты заданий
- •Задание №3 по теме «химическая кинетика и равновесие»
- •Примеры решения задач
- •Вычисление скорости химических реакций
- •1.3. Вычисление константы химического равновесия
- •1.4. Вычисление равновесных концентраций
- •1.5. Направление смещения равновесия
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание № 4 по теме «Растворы»
- •Примеры решения задач
- •1.1. Процентная концентрация
- •Молярная и эквивалентная концентрации
- •1.3. Моляльная концентрация (моляльность) , мольная доля, титр
- •1.4. Осмотическое давление. Закон вант- гоффа
- •1.5. Давление насыщенного пара растворов. Тонометрический закон рауля
- •1.6. Температуры кипения и замерзания растворов.
- •2. Задачи для самостоятельного решения
- •3. Варианты заданий
- •Список рекомендуемой литературы
- •Задание №5 по теме: "растворы электролитов"
- •Примеры решения задач
- •1.1. Вычисление степени диссоциации слабых электролитов
- •1.3. Произведение растворимости
- •1.5. Обменные реакции в растворах электролитов
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание №6 по теме «гидролиз солей»
- •Примеры решения задач
- •Задания для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание № 7 по теме «Окислительно–восстановительные реакции. Электрохимия»
- •Примеры решения задач
- •2. Задания для самостоятельного решения
- •Список рекомендуемой литературы
- •Задание № 8 по теме «Классификация и свойства неорганических веществ»
- •Примеры решения задач
- •Пример 5. С какими из перечисленных веществ вступит в реакцию серная кислота: koh, CuO, Ba(oh)2, Fe2o3, Al2o3, co2, SiO2, h3po4, o2, h2o? Составьте уравнения возможных реакций.
- •Задания для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •3.Варианты заданий
- •Задание № 10 по теме «Дисперсные системы»
- •Пример решения задачи
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список РекомендуемОй литературЫ
- •Сборник заданий для самостоятельной работы студентов по дисциплине «химия
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
Список рекомендуемой литературы
1. Глинка Н.Л. Общая химия.–М.: Интегралл-пресс, 2004.
2. Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии.–М.: Высшая школа, 2005.
3. Сыркин А.М., Зорина Л.Н. Классификация и номенклатура неорганических веществ: учеб. пособие.- Уфа: УГНТУ, 2006.
4. Курс общей химии /под ред. Н.В.Коровина-М.:Высшая школа, 1999.
Задание №9 по теме "Химия воды. Жесткость воды"
-
Примеры решения задач
Методика решения задач по теме "Жесткость воды и методы её умягчения" основана на понятии жесткости, знании единиц измерения жесткости, методов умягчения воды и некоторых общих формул.
Единой международной единицы измерения жесткости не существует. Различные страны условно принимают свои единицы. В нашей стране жесткость выражают в ммоль-эквивалентах (мэкв) ионов Са2+ и Mg2+ (либо соответствующих солей кальция и магния), содержащихся в 1л воды; 1мэкв жесткости соответствует 20,04 мг Са2+ в I л воды или 12,16 мг Mg2+ в 1 л воды.
Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле

где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
![]() –
эквивалентные
массы ионов металлов (или их солей),
мг/экв.
–
эквивалентные
массы ионов металлов (или их солей),
мг/экв.
V – объём воды, л.
Различают карбонатную (или временную) жесткость (Жк) и некарбонатную (или постоянную) жесткость (Жнк). Некарбонатная жесткость представляет собой разность между общей жесткостью и карбонатной:
Жнк = Жобщ - Жк
Временную жесткость воды (Жк) можно определить по объёму кислоты, пошедшей на её титрование. В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Следовательно:
![]() ,
,
где
![]() – объём кислоты, пошедшей на титрование,
мл;
– объём кислоты, пошедшей на титрование,
мл;
![]() – объём
пробы воды, взятой для титрования, мл;
– объём
пробы воды, взятой для титрования, мл;
Сн – нормальная концентрация кислоты, экв./л;
Отсюда:
![]() (мэкв/л).
(мэкв/л).
Аналогично можно рассчитать общую жесткость воды (Жобщ.) по объёму трилона Б, пошедшего на титрование:
![]() (мэкв/л).
(мэкв/л).
Эквивалент
трилона Б равен
![]() г.
г.
Для устранения жесткости на практике часто используется известково-содовый метод. Добавление к воде Ca(OH)2 устраняет карбонатную жесткость (ЖК), а добавление Na2CO3 – некарбонатную жесткость (ЖНК).
 ;
;  ;
;
![]() .
.
Иногда при умягчении воды известково-содовым методом дозы извести и соды, вводимые в воду, определяются пробным умягчением. Для ориентировочных расчетов можно использовать следующие формулы:
![]()
![]()
где
![]() и
и
![]() – содержание извести и соды, мг/л;
– содержание извести и соды, мг/л;
![]() – карбонатная
жесткость, мэкв/л;
– карбонатная
жесткость, мэкв/л;
![]() – магниевая
жесткость, мэкв/л;
– магниевая
жесткость, мэкв/л;
![]() – содержание
диоксида углерода, мэкв/л;
– содержание
диоксида углерода, мэкв/л;
![]() – некарбонатная
жесткость, мэкв/л;
– некарбонатная
жесткость, мэкв/л;
0,5 – избыток реактива, мэкв/л;
28 – масса 1мг-эквивалента оксида кальция, мг;
53 – масса 1мг-эквивалента соды, мг.
Пример1. В образцах природной воды содержатся соли:
1)Ca(HCO3)2; 2) MgSO4; 3) KCl; 4) KHCO3; 5) Na2SO4.
Укажите номер образца воды с постоянной жесткостью.
Решение: Известно, что жесткость воды обусловлена присутствием в ней растворимых солей кальция и магния. В зависимости от природы анионов жесткость подразделяют на карбонатную (или временную) и некарбонатную (постоянную). Исходя из указанного образец воды с постоянной жесткостью будет под номером 2) MgSO4.
Ответ: 2) MgSO4.
Пример 2. Вычислите общую жесткость воды , если в 2 л её находится по
800 мг ионов Mg2+ и Ca2+;
Решение: Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле

где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
![]() –
эквивалентные
массы ионов металлов (или их солей),
мг/экв;
–
эквивалентные
массы ионов металлов (или их солей),
мг/экв;
V – объём воды, л.
Подставим числовые значения в предлагаемую формулу:
![]() 33,33
+ 20 = 53,33 мэкв/л
33,33
+ 20 = 53,33 мэкв/л
Ответ: общая жесткость равна 53,33 мэкв/л.
Пример 3. Рассчитайте общую жесткость воды, в 1 л которой содержится 360 мг гидрокарбоната магния и 24 мг гидрокарбоната кальция.
Решение: Если известны массы ионов или соответствующих им солей, то жесткость считается по формуле
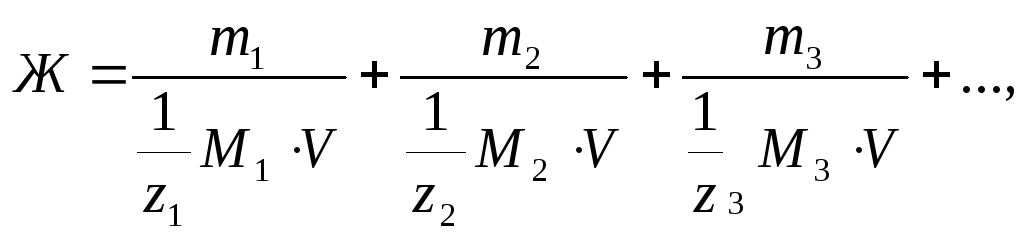
где m1, m2, m3 – массы ионов металлов (или их солей) в воде, мг;
![]() –
эквивалентные
массы ионов металлов (или их солей),
мг/экв;
–
эквивалентные
массы ионов металлов (или их солей),
мг/экв;
V – объём воды, л.
Подставим числовые значения в предлагаемую формулу:
![]() 4,93
+ 0,3 = 5,23 мэкв/л.
4,93
+ 0,3 = 5,23 мэкв/л.
Ответ: общая жесткость равна 5,23 мэкв/л.
Пример 4. Чему равна жесткость воды, если на титрование 100 мл образца её израсходовано 12 мл 0,04 н раствора HCl?
Решение: Временная жесткость воды определяется по объёму кислоты, пошедшей на её титрование:
НСО3- + НС1 = Н2О + СО2↑ + С1-
В соответствии с законом эквивалентов количество эквивалентов всех участвующих в химической реакции веществ должно быть одинаково. Следовательно:
![]() ,
,
где
![]() – объём кислоты, пошедшей на титрование,
мл;
– объём кислоты, пошедшей на титрование,
мл;
![]() – объём
пробы воды, взятой для титрования, мл;
– объём
пробы воды, взятой для титрования, мл;
![]() – нормальная
концентрация кислоты, экв/л;
– нормальная
концентрация кислоты, экв/л;
Отсюда:
![]() =
=
![]() =
4,8мэкв/л.
=
4,8мэкв/л.
Ответ: жесткость равна 4,8мэкв/л.
Пример 5. Постоянную жесткость воды устраняют:
1) кипячением; 2) действием соляной кислоты; 3) действием щелочи;
4) действием соды; 5) действием азотной кислоты.
Решение: Правильный ответ - 4) действием соды, реакция
СаSO4 + Na2CO3 = CaCO3↓ + Na2SO4.
Ответ: 4) действием соды.
Пример 6. Какую массу (г) соды Na2CO3 надо прибавить к 30 л воды, чтобы устранить общую жесткость воды, равную 4,64 мэкв/л?
Решение: Для расчетов используется следующая формула:
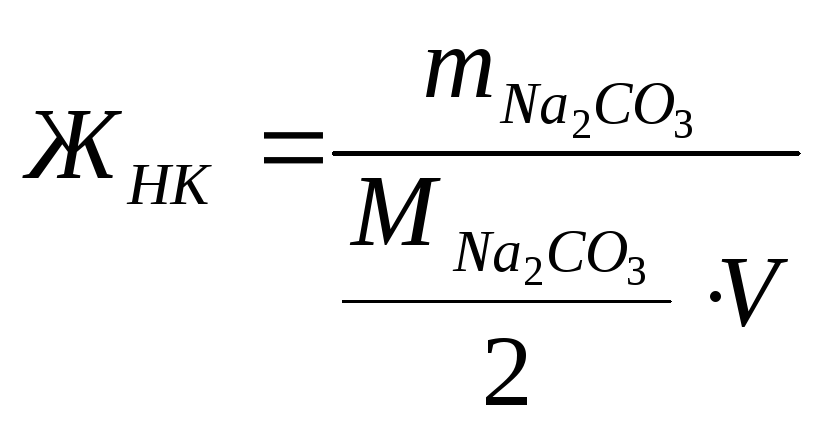 ;
4,64=
;
4,64=
![]() ;
;
Отсюда m(Na2CO3) = 7377,6 мг = 7,4 г.
Ответ: m(Na2CO3) = 7,4 г.
Пример 7. Для умягчения 200 л воды потребовалось 15,9 г Na2CO3. Чему равна жесткость воды (в мэкв/л)?
Решение: используется следующая формула:
 ;
Ж=
;
Ж=
![]() = 1,5 мэкв/л.
= 1,5 мэкв/л.
Ответ: Ж = 1,5 мэкв/л.
