
05 семестр / К экзамену-зачёту / Ответы на экзамен 2 / Билет №39, 40
.docБилет №39
Окисляемость металлов. Коррозионная устойчивость металлов
Все расчеты в термодинамике основываются на использовании функций состояния, называемых термодинамическими потенциалами. Каждому набору независимых параметров соответствует свой термодинамический потенциал
В химических реакциях, идущих при постоянном давлении, одновременно изменяются и энтальпия и энтропия, а процесс протекает в направлении, при котором уменьшается общая движущая сила реакции.
Движущая сила называется свободной энергией или изобарным потенциалом (∆G). По международному соглашению 1961 г. изобарный потенциал назван «свободной энергией Гиббса». Его размерность— Дж/моль. Изобарный потенциал является свойством вещества, выражающим одновременно как его энтальпию (энергию), так и присущую ему энтропию (степень беспорядка).
Основное уравнение термодинамики, связывающее эти величины, имеет вид:
∆G = ∆H - Т∆S. (2.7)
П усть
в системе протекает обратимая химическая
реакция, записанная в обобщенной
форме
усть
в системе протекает обратимая химическая
реакция, записанная в обобщенной
форме
з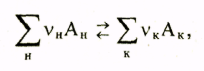 акон
действия масс
акон
действия масс
Величина Кp(Т), зависящая только от температуры и нечувствительная к суммарному давлению Р и исходному составу системы, называется константой химического равновесия. В левой части формулы (3.4) стоит произведение равновесных парциальных давлений для конечных участников реакции, взятых в степенях, равных их стехио-метрическим коэффициентам, деленное на аналогичное произведение для начальных реагентов.
……При этом их
парциальные давления РН
и РК
соответствуют реальной неравновесной
ситуации. Чтобы отличить эти давления
от парциальных давлений в
условиях химического равновесия,
обозначим последние как
![]() Полагая при равновесии ∆G
= 0, в термодинамике доказано:
Полагая при равновесии ∆G
= 0, в термодинамике доказано:

Изобарный потенциал связан с константой равновесия простым соотношением:
∆Gот = ─RTlnKp(T). (2.8) Kp(T)=K
где по закону действия масс (3.4) (с обозначением равновесных давлений в виде Р,)
Выражение (3.21) дает важное для термодинамических расчетов соотношение между стандартным изобарным потенциалом ∆G° и константой химического равновесия КР(Т).

![]()

называемой уравнением изотермы Вант-Гоффа.
Р асчет
констант химического равновесия.
В
основе расчета константы
равновесия
Кp(Т)
для
любой реакции, записанной в обобщенной
форме
(3.1),
лежит соотношение
(3.21), выражающее Кp
через
∆G°т
"
как
асчет
констант химического равновесия.
В
основе расчета константы
равновесия
Кp(Т)
для
любой реакции, записанной в обобщенной
форме
(3.1),
лежит соотношение
(3.21), выражающее Кp
через
∆G°т
"
как
Стандартный изобарный потенциал реакции ∆G°т в этой формуле выражается через тепловой эффект ∆H°т и энтропию ∆°S реакции в стандартных условиях с помощью известного соотношения (3.35):
![]()
Таким образом, расчет зависимости Кp (Т) сводится к вычислению стандартных величин ∆H°т и ∆G°т для конкретной химической реакции при температуре T . Исходными для расчета служат выражения
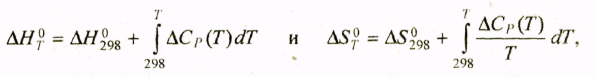
полученные из формул (1.24), (3.36) и (3.37), где ∆H°298 и ∆S°298 — стандартный тепловой эффект и стандартная энтропия реакции при T = 298 К, ∆Cp(T) — изменение изобарной теплоемкости за один пробег реакции слева направо при температуре Т.
Величины ∆H°298, ∆S°298 и ∆Cp вычисляют на основе таблиц стандартных термодинамических величин.
Итак: ∆G° Т = ─RTlnKp(T). (2.8) (в равновесии)
Рассмотрим реакцию окисления металла:
Me + О2 ↔ МеО2 Kр=1/ P/o2 (опустим (Т) : Кр(Т)=Кр)
В газовой атмосфере, содержащей кислород, уравнение для изобарно-изотермического потенциала (3.23) будет иметь вид: ∆G = -RT ln(K)+ RT ln 1/PО2. (2.9)
Выражая
изменение энергии Гиббса через величины
равновесного![]() и
парциального
и
парциального![]() давлений
кислорода, получим
давлений
кислорода, получим
![]() Уравнение
позволяет оценить возможность протекания
процесса окисления.
Если
Уравнение
позволяет оценить возможность протекания
процесса окисления.
Если![]() то
процесс окисления возможен, так как
в
этих
условиях
∆G
<
0.
Если,
то окисление невозможно,
то
процесс окисления возможен, так как
в
этих
условиях
∆G
<
0.
Если,
то окисление невозможно,
ибо
при
этом ∆G
>
0.![]()
Этот
принцип
используют для предотвращения газовой
корозии в ряде
технологических операций, например, в
металлургии. Снижая парциальное
давление
![]() в
газовой среде, предохраняют металл от
окисления
при высоких температурах.
в
газовой среде, предохраняют металл от
окисления
при высоких температурах.
Стремление металлов перейти из металлического в ионное состояние характеризуется величиной уменьшения свободной энергии (∆G°) и составляет сущность процессов химической коррозии.
