
- •Общие методические указания
- •Контрольное задание №1 Тема: «Строение атома»
- •Контрольное задание № 2 Тема: «Химическая связь»
- •Контрольное задание№ 3 Тема: «Энергетика химических процессов»
- •Контрольное задание № 4 Тема: «Химическая кинетика и равновесие»
- •Контрольное задание № 5 Тема: «Диссоциация и реакции ионного обмена»
- •Контрольное задание № 6 Тема: «Гидролиз солей»
- •Контрольное задание № 7 Тема: «Oкислительно-востановительные реакции»
- •Контрольное задание № 8 Тема «Гальванический элемент»
- •Контрольное задание № 9 Тема: «Электролиз»
- •Задачи для вариантов
- •Контрольное задание № 10 Тема: «Коррозия металлов»
- •Контрольное задание № 11 Тема: «Свойства металлов»
- •Вопросы для подготовки к экзамену
- •Типовые задачи для подготовки к экзамену
- •Список литературы
- •Приложения
- •Названия распространённых кислот и их солей
- •Распределение некоторых кислот, оснований и солей по группам в зависимости от величины степени диссоциации
- •Стандартные электродные потенциалы некоторых металлов
Типовые задачи для подготовки к экзамену
-
Определить молярную массу эквивалента алюминия, если известно, что 54г его вытеснило 67,2л водорода, измеренного при нормальных условиях, из раствора соляной кислоты.
-
Составить электронную формулу атома Fe. Представить графическую схему заполнения электронами валентных орбиталей в нормальном и возбужденном состояниях. Определить возможные валентности.
-
Объяснить механизм образования молекулы NH3 по методу валентных связей. Представить электронно-точечную формулу молекулы и определить ее геометрическую форму.
-
Используя данные по теплотам образования и энтропии веществ определить, в каком направлении при стандартных условиях может самопроизвольно протекать реакция: Fe3O4 + CO = 3Feo + CO2 .
-
Вычислить, сколько энергии можно получить от сжигания 100л пропана.
-
Определить температуру, при которой становится возможным протекание реакции: Al2O3 + 3C = 2Al + 3CO .
-
При 150°С реакция заканчивается за 16мин. Принимая температурный коэффициент скорости реакции равным 2, рассчитать, через какое время эта реакция закончится, если ее проводить при 80°С.
-
Как изменится скорость реакции: Fe2O3 + 3CO = 2Feo + CO2
а) при увеличении концентрации CO в 2 раза;
б) при увеличении давления в 2 раза;
в)
при увеличении температуры на 30°С
(![]() =2,5).
=2,5).
-
В каком направлении сместится равновесие в системе:
![]()
а) при повышении давления;
б) при уменьшении концентрации азота;
в)
при повышении температуры (даны
![]() всех
веществ).
всех
веществ).
-
При состоянии равновесия в системе: N2(газ) + 3H2(газ)
 2NH3
2NH3
концентрации участвующих веществ равны: азота 3 моль/л; водорода 9моль/л; аммиака 4моль/л. Рассчитать константу равновесия и начальные концентрации азота и водорода, если начальная концентрация аммиака была равна 0.
-
На нейтрализацию 50мл раствора кислоты израсходовано 25мл 0,5 нормального раствора щелочи. Чему равна нормальность кислоты?
-
Смешали 300г 12%-ного раствора и 500г 30%-ного раствора KCl. Чему равна массовая доля KCl в полученном растворе?
-
При растворении 5г вещества в 200мл воды получился не проводящий тока раствор, кристаллизующийся при -1,45°С. Определить молекулярную массу растворенного вещества. (Криоскопическая постоянная воды равна 1,86).
-
Написать уравнения ступенчатой диссоциации следующих электролитов: H2CO3, Al(OH)3, KH2PO4, Al(OH)2Cl.
-
Вычислить рН 0,1М раствора гидроксида аммония NH4OH (
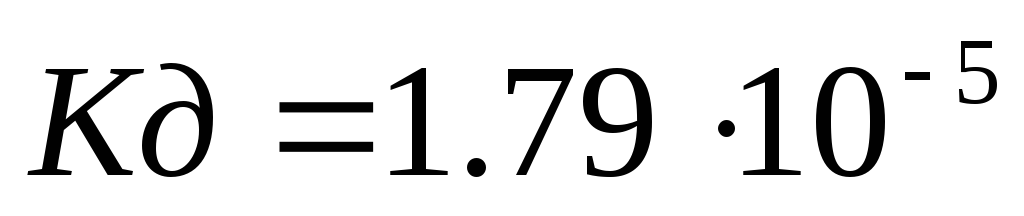 ).
). -
Вычислить рН 0,1М раствора уксусной кислоты CH3COOH (
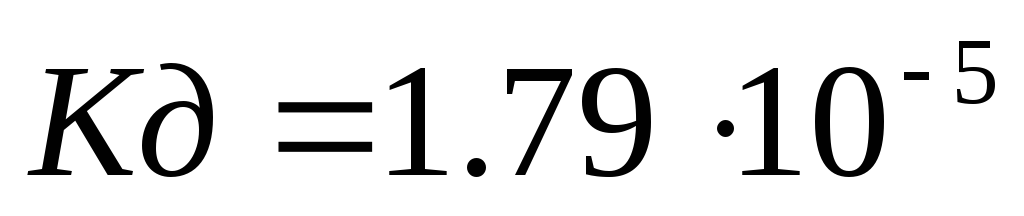 ).
). -
Написать уравнения реакции гидролиза в молекулярной и ионной формах и определить характер среды для следующих солей: AlCl3, K3PO4, NaCN, Al2S3.
-
Определить рН 0,1М раствора Na2S, считая что гидролиз протекает по первой ступени. (Ступенчатые константы диссоциации сероводородной кислоты К1 и К2 равны соответственно
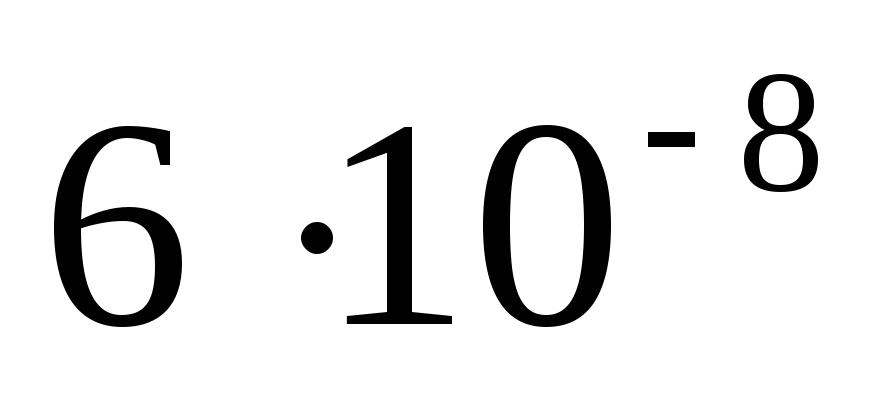 и
и
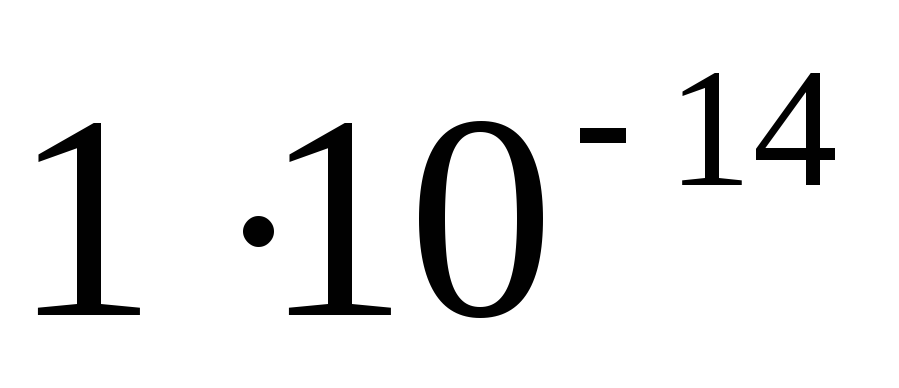 ).
). -
Для реакции:Cr2(SO4)3 + K2SO4 + I2 + H2O = K2Cr2O7 + KI + H2SO4
вывести коэффициенты электронно-ионным методом, указать окислитель и восстановитель. По окислительно-восстановительным потенциалам реагирующих веществ определить, возможно ли самопроизвольное протекание реакции при стандартных условиях.
-
Для комплексного соединения K3[Fe(CN)6] указать комплексо-образователь, координационное число комплексообразователя и его степень окисления. Назвать это соединение и написать уравнение его диссоциации. Написать выражение константы нестойкости комплексного иона. Написать в молекулярной и ионной формах уравнения обменной реакции K3[Fe(CN)6] и FeCl2.
-
Гальванический элемент состоит из водородного электрода (рН=3) и цинкового электрода, погруженного в 0,1М раствор ZnSO4. Составить схему этого элемента. Написать уравнения электродных процессов и суммарной реакции, происходящей при работе элемента. Вычислить электродвижущую силу элемента. Указать, в каком направлении будут перемещаться электроны во внешней цепи при работе этого элемента.
-
Составить схемы двух гальванических элемнтов, в одном из которых медь служила бы катодом, а в другом - анодом. Написать уравнения реакций, протекающих при работе этих элементов, и вычислить значения стандартных ЭДС.
-
Написать уравнения процессов, происходящих при электролизе 0,1М раствора CuSO4 при рН=10 с
а) медными электродами;
б) угольными электродами.
-
При электролизе водного раствора NiSO4 на аноде протекает процесс: 2H2O – 4e‾→O2 + 4H+. Из какого материала сделан анод: а) из никеля; б) из меди; в) из золота?
-
Ток силой 6А пропускали через водный раствор серной кислоты в течение 1,5 часа. Вычислить массу разложившейся воды и объем выделившихся кислорода и водорода (условия нормальные).
-
В каком случае коррозия железа при повреждении покрытия будет происходить быстрее: хромированного или никелированного? Ответ обосновать.
-
Рассчитать возможность электрохимической коррозии пары Fe-Ni при рН=10 с доступом воздуха.
