
- •Раздел 2
- •Глава 11
- •11.1. Общая характеристика
- •11.2. Виды гравиметрических определений
- •11.3. Понятие о механизме образования осадка
- •11.4. Коллоидная стадия образования осадка
- •11.5. Причины загрязнения осадка и способы их устранения
- •11.6. Основные этапы методики гравиметрического определения методом осаждения
- •11.7. Гравиметрия в фармацевтическом анализе
- •Глава 12
- •12.1. Основные понятия титриметрии
- •12.2. Классификация титриметрических методов анализа и способов титрования
- •12.3. Стандартные растворы и стандартные вещества
- •12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
- •Расчёты, связанные с титрованием
- •Глава 13
- •13.1. Титранты и стандартные вещества
- •13.2. Обнаружение конечной точки титрования. Кислотно-основные индикаторы
- •Метиловый красный
- •Тимолфталеин (бесцветный синий)
- •Феноловый красный
- •13.3. Кривые титрования
- •0,10 М раствором NaOh
- •Расчёты для построения кривой титрования
- •Расчёты для построения кривой титрования
- •0,10 М Na2co3 0,10 м раствором hCl
- •13.4. Факторы, влияющие на величину скачка титрования
- •13.5. Погрешности титрования
- •13.6. Некоторые случаи практического применения кислотно-основного титрования в водных растворах
- •Глава 14
- •14.1. Ограничения возможностей кислотно-основного основного титрования в водных растворах
- •14.2. Критерии выбора растворителя для кислотно-основного титрования
- •14.3. Применение в фармацевтическом анализе Титрование в кислотных растворителях
- •Глава 15
- •15.1. Общая характеристика
- •15.2. Меркуриметрическое титрование
- •15.3. Комплексонометрическое титрование
- •15.3.1. Понятие о комплексонах
- •15.3.2. Свойства этилендиаминтетрауксусной кислоты и её взаимодействие с катионами металлов
- •15.3.3. Кривые титрования
- •1,010-3 М раствором эдта при рН 9,50 в присутствии 510-2 м nh3
- •15.3.4. Способы обнаружения конечной точки титрования. Металлоиндикаторы
- •Пирокатехиновый фиолетовый – металлоиндикатор из группы сульфофталеиновых красителей. Представляет собой четырёхосновную кислоту. Комплексы с металлами обычно окрашены в синий цвет.
- •15.3.5. Индикаторные погрешности
- •15.3.6. Титранты и стандартные вещества
- •15.3.7. Способы комплексонометрического титрования и его применение
- •Глава 16
- •16.1. Общая характеристика
- •16.2. Аргентометрическое титрование
- •16.2.1. Кривые титрования
- •Расчёты для построения кривой титрования
- •16.2.2. Способы обнаружения конечной точки титрования
- •Метод Мора
- •Метод Фольгарда
- •Особенность определения хлоридов
- •Особенность определения иодидов
- •Метод Фаянса
- •16.2.3. Титранты и стандартные вещества
- •16.2.4. Применение в фармацевтическом анализе
- •16.3. Меркурометрическое титрование
- •Глава 17
- •17.1. Общая характеристика и классификация
- •17.2. Кривые титрования
- •17.3. Способы обнаружения конечной точки титрования. Окислительно-восстановительные индикаторы
- •Глава 18
- •18.1. Иодометрическое титрование
- •Титранты и стандартные вещества
- •Обнаружение конечной точки титрования
- •18.2. Хлориодометрическое титрование
- •18.3. Иодатометрическое титрование
- •18.4. Броматометрическое титрование
- •18.5. Нитритометрическое титрование
- •18.6. Перманганатометрическое титрование
- •18.8. Дихроматометрическое титрование
- •18.8. Цериметрическое титрование
12.3. Стандартные растворы и стандартные вещества
Как уже упоминалось выше, титрантом называют активный реагент, используемый для титрования. Поскольку титрование обычно проводят с помощью раствора титранта, то иногда титрантом называют не само активное вещество, а его раствор, применяемый для титрования.
Раствор, концентрация активного вещества в котором известна с высокой точностью, называется стандартным раствором.

Стандартным веществом в титриметрии называется реагент, используемый для стандартизации раствора титранта.
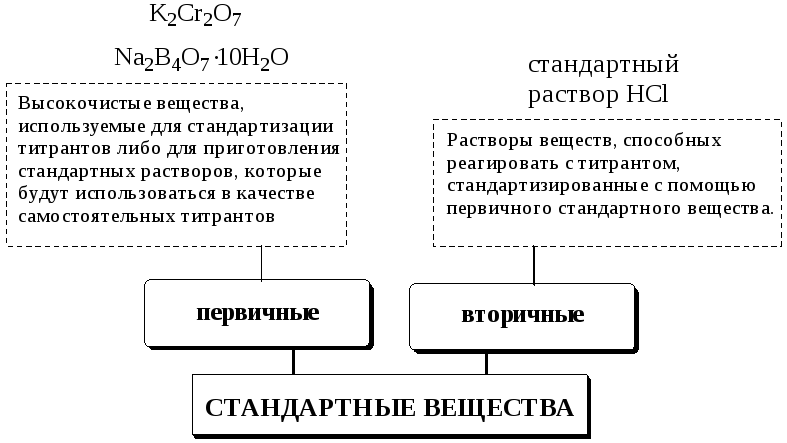
В качестве первичных стандартных веществ используют соединения, обладающие следующими свойствами:
-
состав строго соответствует химической формуле;
-
выпускаются промышленностью в чистом виде (квалификация не ниже «ч.д.а.») либо легко подвергаются очистке;
-
устойчивы при обычных условиях;
-
нелетучи и, по возможности, не содержат кристаллизационной воды (можно использовать и кристаллогидраты, если они устойчивы).
-
имеют большую молярную массу (меньше погрешность при измерении массы).
Растворы титрантов можно готовить также из фиксаналов и методом ионного обмена. Фиксаналом (нормадозой, стандарт-титром) называются приготовленные и расфасованные в промышленных условиях порции вещества, содержащие точно известное его количество. Содержимое фиксанала растворяют в указанном объёме растворителя (обычно объём раствора составляет 1 л) и получают раствор с точной концентрацией растворённого вещества.
12.4. Расчёты, связанные с приготовлением растворов титрантов и титрованием Расчёты, связанные с приготовлением растворов
Количественный состав раствора можно описывать с помощью безразмерных величин и величин, имеющих размерность. Безразмерные величины иначе называются долями.

Из всех видов долей чаще всего, по крайней мере, в аналитической химии, используется массовая доля.
Доли могут выражаться в процентах. Процент – это не единица измерения, а всего лишь синоним величины «одна сотая».
К размерным величинам, используемым для описания количественного состава растворов, относят концентрации вещества в растворе и моляльность растворённого вещества.
Концентрация – это отношение массы или количества растворённого вещества к объёму раствора.
Массовая доля – это, согласно современному подходу, не концентрация и называть её «процентной концентрацией» не следует. Слово «концентрация» переводится на русский язык как «сосредоточение» и относится к растворённому веществу, а не к раствору, т.е. говорят «концентрация растворённого вещества в растворе», а не «концентрация раствора».
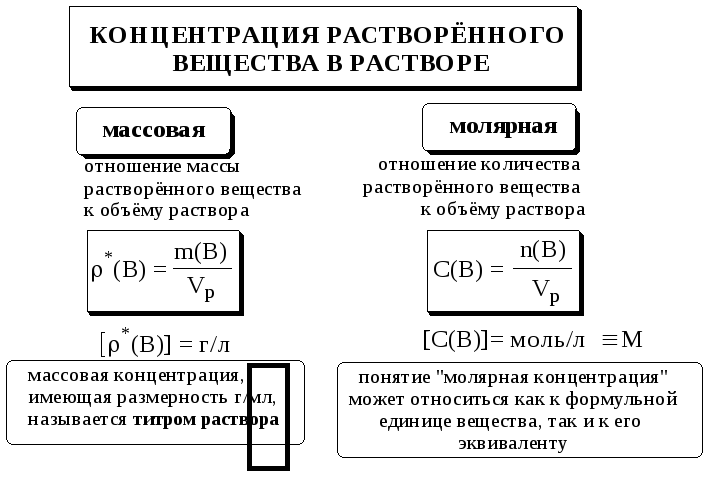
Моляльность растворённого вещества представляет собой отношение количества этого вещества, находящегося в растворе, к массе растворителя. Обозначают моляльность как m(В), b(В), Сm(В). Размерность моляльности – моль/кг. Её используют в тех случаях, когда раствор находится в неизотермических условиях.
Для количественной характеристики стандартных растворов обычно используют молярную концентрацию (вещества или эквивалента вещества). Иногда для этой цели пользуются титром раствора.
Если стандартный раствор титранта используется для серийных анализов, то для его количественной характеристики удобно использовать титр соответствия (титр по определяемому веществу), который показывает массу определяемого вещества, взаимодействующего с 1 мл данного титранта. Например, титр 0,1000 М HCl по NaOH равен 4,00010-3 г/мл.
Титр соответствия рассчитывается заранее для определённой концентрации вещества в стандартном растворе. Представим себе, что в лаборатории закончился 0,1000 М HCl и новый приготовленный раствор HCl оказался немного более концентрированным (или более разбавленным), чем исходный, например 0,1005 М. В таких случаях удобнее не пересчитывать величину титра соответствия, а ввести поправочный коэффициент (k), например, в данном случае он равен 1,005.
Пример 12.1. Какой объём раствора HCl с массовой долей растворённого вещества 16,5% и плотностью 1,08 г/мл необходимо взять для получения 500 мл 0,1 М HCl?
![]()
При использовании полученной формулы объём раствора, который необходимо приготовить, берут в литрах, а массовую долю - в долях единицы.
![]() 10
мл
10
мл
Если объём получаемого раствора брать в мл, а массовую долю вещества в исходном растворе в %, то формула для расчёта будет иметь следующий вид:
![]() =
=
![]() =
=
![]() 10
мл
10
мл
