
- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Деление и умножение
Строгий подход к определению правильного числа значащих цифр, которое должно остаться в произведении или в частном, предполагает сравнение относительных недостоверностей исходных величин и получаемых результатов. В большинстве случаев, однако, можно ограничиться следующим правилом: результат деления или умножения должен иметь столько же значащих цифр (не десятичных знаков!), сколько их содержится в наименее точно известном числе.

Другие операции
При
возведении в степень, равную n,
относительная недостоверность результата
будет в n
раз больше, чем недостоверность исходной
величины. При извлечении квадратного
корня (n
= 1/2) относительная недостоверность
уменьшается в два раза, кубического (n
= 1/3) - в три раза, поэтому можно, например,
считать, что
![]() и т.д. При логарифмировании число значащих
цифр обычно увеличивают. При потенцировании
(взятии антилогарифма) число значащих
цифр, наоборот, уменьшают. Например:
и т.д. При логарифмировании число значащих
цифр обычно увеличивают. При потенцировании
(взятии антилогарифма) число значащих
цифр, наоборот, уменьшают. Например:
lg 0,01 (или lg 110-2) = -2,0
10-2,0 = 0,01 (или 110-2)
10.2. Понятие об аналитическом сигнале
Информацию о качественном и количественном составе анализируемого объекта химик-аналитик получает из аналитического сигнала.
Аналитический сигнал - среднее значение результатов измерения физической величины в заключительной стадии анализа, функционально связанное с содержанием (концентрацией) определяемого компонента. Сам факт появления ожидаемого аналитического сигнала (например, осадка определённого цвета) является качественной характеристикой.

Аналитический сигнал складывается, как правило, из
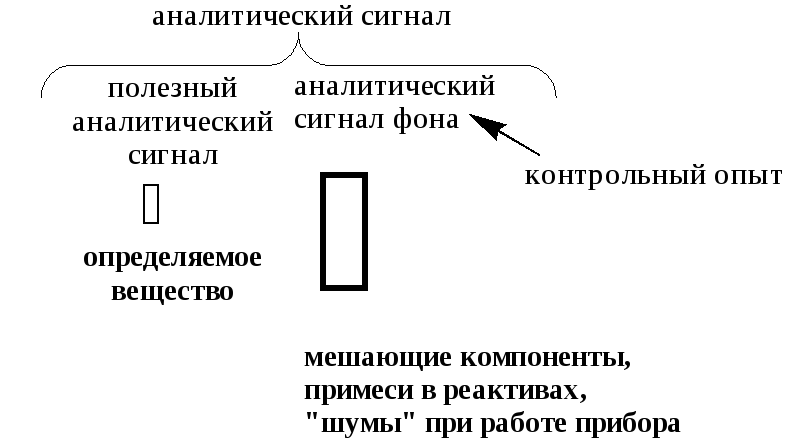
Однократное выполнение всех последовательных операций, предусмотренных методикой анализа, называется единичным определением. Значение содержания вещества, найденное при единичном определении, с указанием единицы измерения называется результатом единичного определения.
Проведенные в практически одинаковых условиях несколько единичных определений называются параллельными определениями. Средний результат параллельных определений называется результатом анализа.
В зависимости от способа расчёта содержания вещества по величине аналитического сигнала методы количественного анализа бывают

Стандартными образцами называют специально приготовленные материалы, состав и свойства которых достоверно установлены и официально аттестованы специальными государственными метрологическими учреждениями.
Стандартные вещества - достаточно чистые и устойчивые вещества известного состава.
10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
Существует 3 основных метода расчёта концентрации по величине аналитического сигнала: метод градуировочного графика, метод стандартов и метод добавок.
Метод градуировочного графика
При использовании данного метода готовится серия стандартных растворов с разными концентрациями вещества, которые считаются точно известными. Затем для каждого приготовленного раствора в одинаковых условиях получают соответствующую величину аналитического сигнала (рис. 10.1).
Для получения градуировочных графиков иногда используют внутренние стандарты - компоненты, содержание которых во всех пробах, используемых для построения градуировочного графика, и в анализируемой пробе одинаково (они могут содержаться в исходной пробе или специально в неё добавляться). В качестве аналитического сигнала в случае использования внутреннего стандарта используют отношение y/yвс.

Рис. 10.1. Построение градуировочного графика и его основные параметры
Уравнения, описывающие градуировочный график, можно получить методом наименьших квадратов: коэффициенты a и b должны быть такими, чтобы сумма квадратов отклонений реальных значений от рассчитанных по полученному уравнению была бы минимальной. Согласно методу наименьших квадратов коэффициенты b и a рассчитываются по следующим формулам:
-
градуировочный график не проходит через начало координат
![]()
![]()
-
градуировочный график проходит через начало координат
![]()
«Качество» полученного градуировочного графика можно охарактеризовать коэффициентом корреляции (r). Чем ближе его значение к 1, чем меньше разброс точек относительно полученной прямой. Для практических целей рекомендуется использовать градуировочные графики c r > 0,99.
Градуировочный график желательно строить в таком интервале, чтобы неизвестная концентрация вещества попадала примерно в его середину, так как погрешность при этом будет минимальной.
Пример 10.1. При измерении оптической плотности растворов с известной концентрацией растворённого вещества были получены следующие значения:
|
С, мг/л |
1,00 |
3,00 |
5,00 |
7,00 |
9,00 |
|
A |
0,125 |
0,350 |
0,570 |
0,795 |
1,010 |
Раствор с неизвестной концентрацией вещества имел оптическую плотность 0,500. Определить концентрацию вещества в данном растворе.
Методом наименьших квадратов можно определить, что
A = 0,111C + 0,016 (r = 0,999)
Для расчётов удобнее использовать обратное уравнение градуировочного графика, характеризующего зависимость концентрации от оптической плотности. Для данного случая
C = 9,03A - 0,15
Концентрация вещества в исследуемом растворе равна 4,37 мг/л.
