
- •Раздел 1
- •Глава 1
- •1.1. Предмет аналитической химии
- •1.2. Принцип, метод и методика анализа
- •1.3. Виды анализа
- •1.4. Методы аналитической химии
- •Глава 2
- •Первая аналитическая группа катионов
- •Вторая аналитическая группа катионов
- •Систематический анализ смеси Cl-, Br-, I- - ионов
- •Глава 3
- •3.2. Активность и коэффициент активности
- •Активность (a) - такая концентрация вещества в растворе, при использовании которой свойства данного раствора могут быть описаны теми же уравнениями, что и свойства идеального раствора.
- •0,100 Моль/л
- •0,100 Моль/л
- •3.4. Виды констант химического равновесия, используемые в аналитической химии в аналитической химии используются
- •3.5. Общие принципы расчёта состава равновесных систем
- •Уравнение материального баланса основано на том, что число атомов определённого элемента (или групп атомов определённого вида) в изолированной системе остаётся неизменным.
- •Глава 4
- •4.1. Важнейшие теории кислот и оснований
- •4.3. Влияние растворителя на кислотно-основные свойства растворённого вещества
- •4.4. Нивелирующее и дифференцирующее действие растворителя. Сильные и слабые кислоты и основания
- •Растворы амфолитов
- •4.6. Расчёт состава равновесных смесей протолитов при заданном значении рН
- •4.7. Кислотно-основные буферные растворы
- •Глава 5
- •5.1. Понятие о комплексном соединении
- •5.2. Классификация комплексных соединений
- •5.3. Равновесия в растворах комплексных соединений
- •Природа комплексообразователя и лигандов
- •Концентрация реагентов
- •Ионная сила
- •Температура
- •Побочные реакции
- •Глава 6
- •6.1. Произведение растворимости малорастворимого электролита
- •6.2. Растворимость
- •7,210-4 Моль/л
- •6.3. Влияние различных факторов на растворимость Природа растворяемого вещества и растворителя
- •Температура
- •Ионная сила
- •Общий (одноименный) ион
- •Побочные реакции
- •6.4. Общие принципы растворения осадков малорастворимых электролитов
- •Глава 7
- •Электродные потенциалы
- •Уравнение Нернста
- •7.3. Влияние различных факторов на протекание окислительно-восстановительных реакций Температура
- •Посторонние ионы
- •Влияние рН
- •Образование малорастворимых соединений
- •7.4. Расчёт различных констант с использованием электродного потенциала
- •Глава 8
- •8.1. Отбор пробы
- •8.2. Разложение пробы
- •Глава 9
- •9.2. Жидкость - жидкостная экстракция
- •9.2.2. Экстракционные системы и экстрагенты
- •9.2.4. Влияние различных факторов на процесс экстракции
- •Слабые основания
- •Амфолиты
- •Присутствие сильных электролитов
- •9.2.5 Способы осуществления экстракции
- •9.2.6. Применение экстракции
- •Глава 10
- •10.1. Приближённые вычисления и значащие цифры
- •Сложение и вычитание
- •Деление и умножение
- •Другие операции
- •10.2. Понятие об аналитическом сигнале
- •10.3. Методы расчёта концентрации вещества по величине аналитического сигнала
- •Метод градуировочного графика
- •Метод стандартов
- •10.4. Неопределённость и погрешности измерений
- •10.5. Некоторые основные положения математической статистики, используемые в аналитической химии
- •10.7. Основные характеристики методики анализа
- •Воспроизводимость
- •Правильность
Раздел 1
Глава 1

1.1. Предмет аналитической химии
Существуют различные определения понятия «аналитическая химия», например:
Аналитическая химия - это наука о принципах, методах и средствах определения химического состава и структуры веществ.
Аналитическая химия - это научная дисциплина, которая развивает и применяет методы, приборы и общие подходы для получения информации о составе и природе вещества в пространстве и времени (определение, принятое Федерацией европейских химических обществ в 1993 году).
Задачей аналитической химии является создание и совершенствование её методов, определение границ их применимости, оценка метрологических и других характеристик, разработка методик анализа конкретных объектов.
Система, которая обеспечивает конкретный анализ определённых объектов с использованием методов, рекомендуемых аналитической химией, называется аналитической службой.
Основной задачей фармацевтической аналитической службы является контроль качества лекарственных средств, выпускаемых химико-фармацевтической промышленностью и приготовленных в аптеках. Такой контроль проводится в аналитических лабораториях химико-фармацевтических заводов, контрольно-аналитических лабораториях и в аптеках.
1.2. Принцип, метод и методика анализа
Анализ - совокупность действий, целью которых является получение информации о химическом составе объекта.
Принцип анализа - явление, которое используется для получения аналитической информации.
Метод анализа - краткое изложение принципов, положенных в основу анализа вещества (без указания определяемого компонента и объекта).
Методика анализа - подробное описание выполнения анализа данного объекта с использованием выбранного метода, которое обеспечивает регламентированные характеристики правильности и воспроизводимости.
Несколько различных методов анализа могут иметь одинаковый принцип. На одном и том же методе анализа может быть основано множество различных методик выполнения анализа.
Методика анализа может включать в себя следующие этапы:
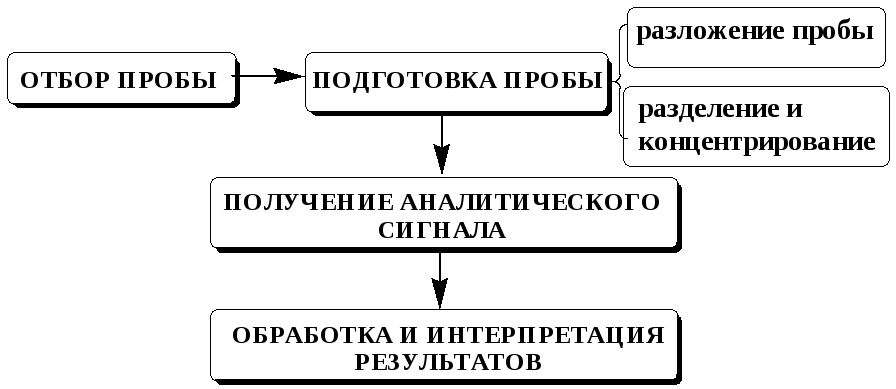
Конкретная методика анализа не обязательно должна включать в себя все из перечисленных этапов. Набор выполняемых операций зависит от сложности состава анализируемого образца, концентрации определяемого вещества, целей выполнения анализа, допустимой погрешности результата анализа и от того, какой метод анализа предполагается использовать.
1.3. Виды анализа
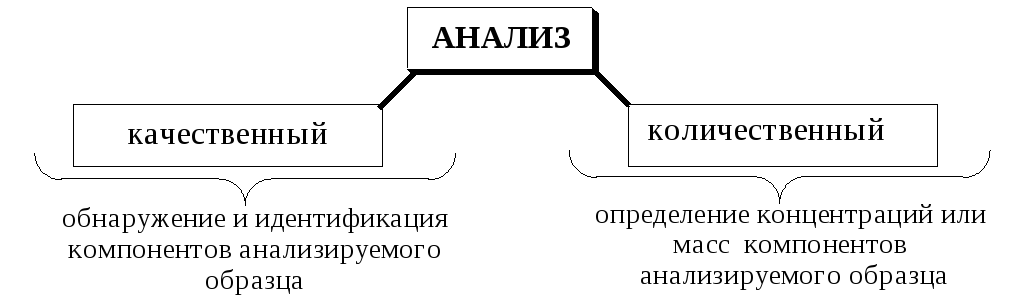
В зависимости от цели различают:
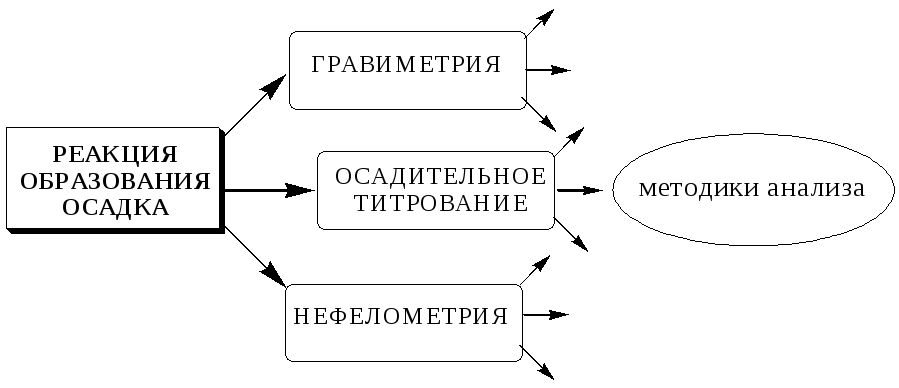
В зависимости от того, какие именно компоненты следует обнаружить или определить, анализ может быть:
-
изотопный (отдельные изотопы);
-
элементный (элементный состав соединения);
-
структурно-групповой /функциональный/ (функциональные группы);
-
молекулярный (индивидуальные химические соединения, характеризующиеся определённой молекулярной массой);
-
фазовый (отдельные фазы в неоднородном объекте).
В зависимости от массы или объёма анализируемой пробы различают:
-
макроанализ (> 0,1 г / 10 – 103 мл);
-
полумикроанализ (0,01 - 0,1 г / 10-1 – 10 мл ),
-
микроанализ (< 0,01 г / 10-2 – 1 мл);
-
субмикроанализ (10-4 – 10-3 г / < 10-2 мл);
-
ультрамикроанализ (< 10-4 г / < 10-3 мл).
